题目内容
用括号中的试剂除去下列各物质中的少量杂质,其中正确的是( )
| A、苯中的甲苯(溴水) |
| B、甲烷中的乙烯(KMnO4酸性溶液) |
| C、四氯化碳中的乙醇(水) |
| D、溴苯中的溴(水) |
考点:物质的分离、提纯的基本方法选择与应用,物质的分离、提纯和除杂
专题:
分析:A.溴易溶于苯,且甲苯与溴水不反应;
B.乙烯被高锰酸钾氧化后生成二氧化碳;
C.乙醇与水互溶,与四氯化碳分层;
D.溴不易溶于水,易溶于溴苯.
B.乙烯被高锰酸钾氧化后生成二氧化碳;
C.乙醇与水互溶,与四氯化碳分层;
D.溴不易溶于水,易溶于溴苯.
解答:
解:A.溴易溶于苯,且甲苯与溴水不反应,则加溴水不能除杂,应选高锰酸钾溶液除杂,故A错误;
B.乙烯被高锰酸钾氧化后生成二氧化碳,引入新杂质,应选溴水除杂,故B错误;
C.乙醇与水互溶,与四氯化碳分层,则加水可除杂,故C正确;
D.溴不易溶于水,易溶于溴苯,则加水不能除杂,应选NaOH溶液除杂,故D错误;
故选C.
B.乙烯被高锰酸钾氧化后生成二氧化碳,引入新杂质,应选溴水除杂,故B错误;
C.乙醇与水互溶,与四氯化碳分层,则加水可除杂,故C正确;
D.溴不易溶于水,易溶于溴苯,则加水不能除杂,应选NaOH溶液除杂,故D错误;
故选C.
点评:本题考查物质的分离提纯方法及应用,为高频考点,把握物质的性质、性质差异及混合物分离方法选择为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
下列用电子式表示的形成过程正确的是( )
A、H×+?Cl:→H+[
| ||||
B、Na×+?Br:→Na
| ||||
C、×Mg×+2?F:→Mg2+[
| ||||
D、 |
下列物质:①乙烷;②苯;③聚乙烯;④聚氯乙烯;⑤丁炔;⑥环己烷;⑦邻二甲苯;⑧3-甲基-1-戊烯.其中能使酸性KMnO4溶液褪色,也能与溴水发生化学反应而褪色的是( )
| A、⑤⑧ | B、③⑤⑦⑧ |
| C、③④⑤⑦ | D、④⑤⑦ |
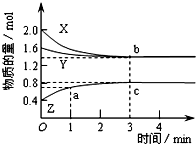 某温度时,在体积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,其中a、b、c三点的坐标分别为(1,0.7)、(3,1.4)、(3,0.8).下列说法中正确的是( )
某温度时,在体积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,其中a、b、c三点的坐标分别为(1,0.7)、(3,1.4)、(3,0.8).下列说法中正确的是( )| A、该反应的化学方程式是3X+Y=2Z |
| B、3 min时,X的转化率为70% |
| C、达平衡时,c(Y)=0.7 mol?L-1 |
| D、前1 min内,v(Z)=0.3 mol?L-1?min-1 |
下列推断合理的是( )
| A、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| B、金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 |
| C、浓H2SO4有强氧化性,不能与Cu发生剧烈反应 |
| D、将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水色后加热也能恢复原色 |
用石墨电极电解足量硝酸银溶液,在阳极收集到0.40克氧气,中和电解时生成的酸需250 毫升氢氧化钠溶液,则氢氧化钠溶液的浓度是( )
| A、0.20 摩/升 |
| B、0.15 摩/升 |
| C、0.10 摩/升 |
| D、0.05 摩/升 |
 工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.
 在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:
在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题: