题目内容
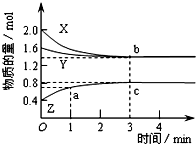 某温度时,在体积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,其中a、b、c三点的坐标分别为(1,0.7)、(3,1.4)、(3,0.8).下列说法中正确的是( )
某温度时,在体积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,其中a、b、c三点的坐标分别为(1,0.7)、(3,1.4)、(3,0.8).下列说法中正确的是( )| A、该反应的化学方程式是3X+Y=2Z |
| B、3 min时,X的转化率为70% |
| C、达平衡时,c(Y)=0.7 mol?L-1 |
| D、前1 min内,v(Z)=0.3 mol?L-1?min-1 |
考点:物质的量或浓度随时间的变化曲线
专题:
分析:根据图象可知,在3min时达到平衡状态,X的物质的量减小:2.0mol-1.4mol=0.6mol,Y的物质的量减小:1.6mol-1.4mol=0.2mol,Z的物质的量增加了:0.8mol-0.4mol=0.4mol,根据化学反应速率与化学计量数成正比可知,X、Y、Z的计量数之比为:0.6mol:0.2mol:0.4mol=3:1:2,该反应方程式为:3X+Y?2Z;
A.根据该反应为可逆反应判断;
B.根据3min时X的物质的量变化为0.6mol及初始物质的量计算出X的转化率;
C.根据c=
计算出达到平衡时的c(Y);
D.根据a点坐标计算出Z的物质的量变化,然后根据v=
计算出前1min的v(Z).
A.根据该反应为可逆反应判断;
B.根据3min时X的物质的量变化为0.6mol及初始物质的量计算出X的转化率;
C.根据c=
| n |
| V |
D.根据a点坐标计算出Z的物质的量变化,然后根据v=
| △c |
| △t |
解答:
解:A.在3min时达到平衡状态,X的物质的量减小:2.0mol-1.4mol=0.6mol,Y的物质的量减小:1.6mol-1.4mol=0.2mol,Z的物质的量增加了:0.8mol-0.4mol=0.4mol,根据化学反应速率与化学计量数成正比可知,X、Y、Z的计量数之比为:0.6mol:0.2mol:0.4mol=3:1:2,该反应方程式为:3X+Y?2Z,该反应为可逆反应,故A错误;
B.3min时X的物质的量变化为0.6mol,初始物质的量为2.0mol,则3min时X的转化率为:
×100%=30%,故B错误;
C.达到平衡时Y的物质的量为1.4mol,则c(Y)=
=0.7mol/L,故C正确;
D.a点坐标计算出Z的物质的量变化为0.4mol,则用Z表示的反应速率为:v(Z)=
=0.2 mol?L-1?min-1,故D错误;
故选C.
B.3min时X的物质的量变化为0.6mol,初始物质的量为2.0mol,则3min时X的转化率为:
| 0.6mol |
| 2.0mol |
C.达到平衡时Y的物质的量为1.4mol,则c(Y)=
| 1.4mol |
| 2L |
D.a点坐标计算出Z的物质的量变化为0.4mol,则用Z表示的反应速率为:v(Z)=
| ||
| 1min |
故选C.
点评:本题考查了物质的量随时间变化的曲线,题目难度中等,明确图象中曲线变化的含义为解答关键,注意掌握物质的量浓度、化学反应速率的概念及计算方法,A为易错点,注意该反应为可逆反应.

练习册系列答案
相关题目
根据等电子原理,下列分子或离子与SO42-有相似结构的是( )
| A、PCl5 |
| B、CCl4 |
| C、NF3 |
| D、NO3- |
一种从植物中提取的天然化合物adamascone,可用于制作“香水”,其结构为: ,有关该化合物的下列说法不正确的是( )
,有关该化合物的下列说法不正确的是( )
 ,有关该化合物的下列说法不正确的是( )
,有关该化合物的下列说法不正确的是( )| A、分子式为C13H20O |
| B、该化合物可发生聚合反应 |
| C、1 mol该化合物完全燃烧消耗19 mol O2 |
| D、与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验 |
 在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)?2HBr(g)△H<0.当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法不正确的是( )
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)?2HBr(g)△H<0.当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法不正确的是( )| A、由图可知:T1>T2 |
| B、a、b两点的反应速率:a<b |
| C、为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法 |
| D、T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加 |
用括号中的试剂除去下列各物质中的少量杂质,其中正确的是( )
| A、苯中的甲苯(溴水) |
| B、甲烷中的乙烯(KMnO4酸性溶液) |
| C、四氯化碳中的乙醇(水) |
| D、溴苯中的溴(水) |
实验室中保存下列化学药品的方法不妥当的是( )
| A、将AgNO3晶体放在棕色试剂瓶中 |
| B、将NaOH溶液保存在带橡胶塞的细口试剂瓶中 |
| C、金属钾、钠和锂保存在煤油中 |
| D、浓硝酸保存在棕色试剂瓶中 |
 如图中的四条线表示钠、镁、铝、铁分别和足量Cl2反应时,消耗金属的质量(纵轴)与参加反应的氯气质量(横轴)的关系,其中代表铁与氯气反应的是( )
如图中的四条线表示钠、镁、铝、铁分别和足量Cl2反应时,消耗金属的质量(纵轴)与参加反应的氯气质量(横轴)的关系,其中代表铁与氯气反应的是( )