题目内容
具有相同电子层数的A、B、C三种元素,已知它们最高价氧化物对应水化物的酸性强弱的顺序是HAO4>H2BO4>H3CO4,则下列判断正确的是( )
| A、原子半径:A>B>C |
| B、单质的氧化性:B>A>C |
| C、气态氢化物的稳定性:A<B<C |
| D、原子序数:A>B>C |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:具有相同电子层数的A、B、C三种元素处于同一周期,它们最高价氧化物对应水化物的酸性强弱的顺序是HAO4>H2BO4>H3CO4,则非金属性A>B>C,同周期随原子序数增大,元素非金属性增强,则原子序数:A>B>C,结合同周期随原子序数增大,元素原子半径减小、单质的氧化性增强、气态氢化物稳定性增强解答.
解答:
解:具有相同电子层数的A、B、C三种元素处于同一周期,它们最高价氧化物对应水化物的酸性强弱的顺序是HAO4>H2BO4>H3CO4,则非金属性A>B>C,同周期随原子序数增大,元素非金属性增强,原子序数:A>B>C,
A.同周期元素原子半径从左到右原子半径逐渐减小,原子序数:A>B>C,则原子半径A<B<C,故A错误;
B.非金属性:A>B>C,非金属性越强,对应单质的氧化性越强,故B错误;
C.非金属性:A>B>C,非金属性越强,对应氢化物的稳定性越强,故C错误;
D.非金属性A>B>C,同周期随原子序数增大,元素非金属性增强,故原子序数:A>B>C,故D正确,
故选D.
A.同周期元素原子半径从左到右原子半径逐渐减小,原子序数:A>B>C,则原子半径A<B<C,故A错误;
B.非金属性:A>B>C,非金属性越强,对应单质的氧化性越强,故B错误;
C.非金属性:A>B>C,非金属性越强,对应氢化物的稳定性越强,故C错误;
D.非金属性A>B>C,同周期随原子序数增大,元素非金属性增强,故原子序数:A>B>C,故D正确,
故选D.
点评:本题考查同周期元素非金属性的递变,题目难度不大,注意掌握同周期元素性质的递变规律.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
下列各实验装置图的叙述中,正确的是( )
A、 装置①为放出萃取溴水后的苯层 |
B、 装置②为喷泉实验 |
C、 装置③不能用来吸收HCl气体 |
D、 以NH4Cl为原料,装置④可用于制备少量NH3 |
已知断开1mol H-H键吸收的能量为436kJ,断开1mol H-N键吸收的能量为391kJ,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,则断开1mol N≡N键吸收的能量是( )
| A、431 kJ |
| B、945.6 kJ |
| C、649 kJ |
| D、869 kJ |
为除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下,加入一种试剂,过滤后再加入适量盐酸,这试剂不可以是( )
| A、NH3?H2O |
| B、MgO |
| C、Mg(OH)2 |
| D、MgCO3 |
常温下能用铁罐或铝罐贮存的是( )
| A、浓H2SO4 |
| B、浓HCl |
| C、稀H2SO4 |
| D、稀HCl |
高铁电池是一种新型电池,与普通高能电池相比,该电池长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O═3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| A、放电时正极反应为:Zn-2e-+2OH-═Zn(OH)2 |
| B、该原电池,Zn作正极,可用石墨等作负极 |
| C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化 |
| D、放电时正极附近溶液的碱性增强 |
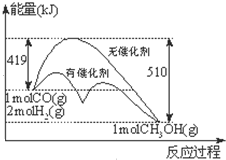 反应CO(g)+2H2(g)?CH3OH(g)过程中能量的变化如图示.下列判断不正确的是( )
反应CO(g)+2H2(g)?CH3OH(g)过程中能量的变化如图示.下列判断不正确的是( )| A、达到平衡时,升高温度,CO的转化率减小 |
| B、1mol CO(g)和2mol H2(g)在密闭容器中反应,达平衡时,放出的热量为91KJ |
| C、相同条件下,1mol CO(g)和2mol H2(g)完全反应生成1mol液态CH3OH放出的热量大于91KJ |
| D、反应热取决于反应物总能量与生成物总能量的相对大小,与反应发生的条件无关 |