题目内容
9.下列各组离子能在溶液中大量共存的是( )| A. | Na+、Mg2+、Cl-、OH- | B. | H+、Ca2+、CO32-、NO3- | ||
| C. | Na+、HCO3-、OH-、Ca2+ | D. | Cu2+、K+、SO42-、NO3- |
分析 A.氢氧根离子与镁离子反应生成氢氧化镁沉淀;
B.氢离子、钙离子与碳酸根离子反应;
C.碳酸氢根离子、钙离子与氢氧根离子反应生成碳酸钙沉淀;
D.四种离子之间不反应,能够共存.
解答 解:A.Mg2+、OH-之间反应生成难溶物氢氧化镁,在溶液中不能大量共存,故A错误;
B.H+、Ca2+与CO32-之间发生反应,在溶液中不能大量共存,故B错误;
C.HCO3-、OH-、Ca2+之间反应生成碳酸钙沉淀,在溶液中不能大量共存,故C错误;
D.Cu2+、K+、SO42-、NO3-之间不发生反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
20.下列试剂的保存方式正确的是( )
| A. | 漂白粉不需要密封保存 | |
| B. | FeCl2溶液保存时加入少量铁粉 | |
| C. | 镁条应保存在煤油中 | |
| D. | NaOH溶液应保存在配有玻璃塞的试剂瓶中 |
4.下列离子方程式的书写及评价,均合理的是( )
| 选项 | 离子方程式 | 评价 |
| A | 将2molCl2通入到含lmolFeI2的溶液中:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | 正确:Cl2过量,可将Fe2+、I-均氧化 |
| B | 稀硝酸中加过量铁粉:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | 正确:过量的Fe还原了Fe3+ |
| C | 过量SO2通入到NaClO 溶液中:ClO-+SO2+H2O═HSO3-+HClO | 正确:说明酸性:H2SO3强于HClO |
| D | Mg(HCO3)2溶液与足量的NaOH 溶液反应:Mg2++HCO3-+OH-═MgCO3↓+H2O+CO32- | 正确:酸式盐与碱反应生成正盐和水 |
| A. | A | B. | B | C. | C | D. | D |
14.下列有关试剂的保存方法错误的是( )
| A. | 氢氧化钠溶液保存在具有玻璃塞的试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 浓硝酸保存在棕色玻璃试剂瓶中 |
1.在卤素中,其最高价氧化物对应水化物的酸性最强的是( )
| A. | F | B. | Cl | C. | Br | D. | I |
18.设NA为阿伏加德罗常数的值,下列叙述错误的是( )
| A. | 13g 和 和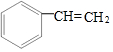 的混合物中含有的电子数为7NA 的混合物中含有的电子数为7NA | |
| B. | 60gSiO2中含有的共价键数目为4NA | |
| C. | 标准状况下,11.2LH2和Cl2反应后得到的气体中含有的原子总数为NA | |
| D. | 1molNaCO3溶于水后,所得溶液中CO32-和HCO3-的总数为NA |
14.下列离子方程式中正确的是( )
| A. | Cu溶于稀HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| B. | 用石墨电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| D. | 向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |