题目内容
16.下列溶液氯离子的物质的量浓度与50mL 1mol•L-1AlCl3溶液中氯离子的物质的量浓度相等的是( )| A. | 150 mL 3 mol•L-1氯酸钾溶液 | B. | 75 mL 3 mol•L-1氯化钙溶液 | ||
| C. | 150 mL 3 mol•L-1氯化钾溶液 | D. | 50 mL 3 mol•L-1氯化镁溶液 |
分析 强电解质溶液中离子浓度=电解质浓度×化学式中相应离子数目,与溶液体积无关,与物质的组成有关,1mol•L-1 AlCl3溶液中的c (Cl-)=3mol/L.
解答 解:50mL 1mol•L-1 AlCl3溶液中c (Cl-)=3×1mol/L=3mol/L,
A.氯酸钾溶液中没有氯离子,故A不符合;
B.75mL 3mol•L-1 氯化钙溶液中c (Cl-)=2×3mol/L=6mol/L,故B不符合;
C.150mL 3mol•L-1 氯化钾溶液中c (Cl-)=1×3mol/L=3mol/L,故C符合;
D.50 mL 3 mol•L-1氯化镁溶液中c (Cl-)=2×3mol/L=6mol/L,故D不符合,
故选:C.
点评 本题考查物质的量浓度的计算,难度不大,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列化学用语或化学知识表述正确的是( )
| A. | 基态碳原子核外电子排布图是: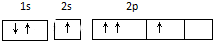 | |
| B. |  和 和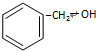 是同系物,性质相似 是同系物,性质相似 | |
| C. | 过氧化钠的电子式: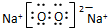 | |
| D. | 常见的化学键有:离子键、共价键、金属键、氢键等 |
7.下列有关除杂质(括号中为杂质)的操作中,错误的是( )
| A. | 福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 甘油(水):用分液漏斗分离 | |
| C. | 苯(苯酚):加NaOH溶液,充分振荡,分液 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液 |
4.在水溶液中能大量共存的一组离子是( )
| A. | CO32-、H+、NO3-、Na+ | B. | OH-、K+、NO3-、Cl- | ||
| C. | Mg2+、H+、OH-、SO42- | D. | Na+、Cu2+、OH-、SO42- |
8.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 一定条件下,6.4 g铜与过量的硫反应,转移电子数目为0.2NA | |
| B. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| C. | 标准状况下,11.2L SO3 中含有2NA个原子 | |
| D. | 用石灰乳完全吸收1 mol Cl2时,转移电子的数目是2NA |
5.下表列出了①~⑨九种元素在周期表中的位置.
请按要求回答下列问题.
(1)这九种元素中,原子半径最大的是(填元素符号)K;元素⑤的原子结构示意图为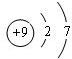 .
.
(2)③、④、⑤三种元素的气态氢化物中,热稳定性最弱的物质是(填化学式)CH4.
(3)写出元素⑧的单质与水反应的化学方程式:2K+2H2O═2KOH+H2↑.
(4)写出元素⑦的单质与元素⑨的钠盐溶液反应的离子方程式:Cl2+2Br-═Br2+2Cl-.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ||||||
| 4 | ⑧ | ⑨ | ||||||
(1)这九种元素中,原子半径最大的是(填元素符号)K;元素⑤的原子结构示意图为
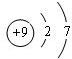 .
.(2)③、④、⑤三种元素的气态氢化物中,热稳定性最弱的物质是(填化学式)CH4.
(3)写出元素⑧的单质与水反应的化学方程式:2K+2H2O═2KOH+H2↑.
(4)写出元素⑦的单质与元素⑨的钠盐溶液反应的离子方程式:Cl2+2Br-═Br2+2Cl-.
2.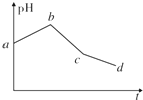 将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )
将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )
 将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )
将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )| A. | ab段表示电解过程中H+被还原,pH上升 | |
| B. | 电解开始时阳极先发生电极反应2Cl--2e-═Cl2↑ | |
| C. | 电解至c点时,往电解液中加入适量CuCl2固体,即可使电解液恢复至原来的浓度 | |
| D. | 原混合溶液中KCl和CuSO4的浓度之比恰好为2:1 |
 (1)稀释0.1mol•L-1氨水时,随着水量的增加而减小的是①②(填写序号).
(1)稀释0.1mol•L-1氨水时,随着水量的增加而减小的是①②(填写序号).