题目内容
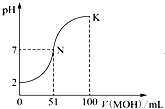 常温下向100mL 0.01mol?L-1 HA溶液中逐滴加入0.02mol?L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下向100mL 0.01mol?L-1 HA溶液中逐滴加入0.02mol?L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:(1)由图中信息可知,MOH为
(2)常温下,一定浓度的MA稀溶液的pH=5,用离子方程式表示其原因:
(3)请写出K点所对应的溶液中离子浓度的大小关系:
(4)K点对应的溶液中,c(M+)+c(MOH)
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:(1)0.01mol?L-1HA溶液的pH=2,说明HA完全电离为强酸,100mL 0.01mol?L-1 HA溶液中逐滴加入0.02mol?L-1 MOH溶液,当MOH体积为51mL时,为中性,则碱过量;
(2)写出M+离子水解的离子方程式;盐溶液中水电离的氢氧根离子就等于溶液中的氢离子浓度;
(3)K点MOH的物质的量远远大于HA的物质的量,溶液显示碱性,据此进行比较离子浓度大小;
(4)根据溶液中的物料守恒进行判断浓度关系;根据溶液中的电荷守恒和物料守恒进行计算.
(2)写出M+离子水解的离子方程式;盐溶液中水电离的氢氧根离子就等于溶液中的氢离子浓度;
(3)K点MOH的物质的量远远大于HA的物质的量,溶液显示碱性,据此进行比较离子浓度大小;
(4)根据溶液中的物料守恒进行判断浓度关系;根据溶液中的电荷守恒和物料守恒进行计算.
解答:
解:(1)0.01mol?L-1HA溶液的pH=2,说明HA完全电离为强酸,100mL 0.01mol?L-1 HA溶液中逐滴加入0.02mol?L-1 MOH溶液,当MOH体积为51mL时,为中性,则碱过量时为中性,说明二者恰好反应时为酸性,所以M+水解显酸性,即MOH为弱碱;
故答案为:弱;
(2)MA属于强酸弱碱盐,水解显示酸性,M+离子结合水电离的氢氧根离子生成了MOH,水解离子方程式为:M++H2O?MOH+H+;水电离的氢氧根离子等于溶液中氢离子的浓度,即c(OH-)=1×10-5mol?L-1,
故答案为:M++H2O?MOH+H+;1×10-5;
(3)由于在K点,MOH的物质的量远远大于HA的物质的量,溶液显示碱性,所以溶液中浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+),
故答案为:c(M+)>c(A-)>c(OH-)>c(H+);
(4)K点时,加入的MOH的物质的量=0.02mol?L-1×0.1L=0.002mol,混合溶液的体积是0.2L,根据物料守恒知,c(M+)+c(MOH)=
=0.01mol/L,
HA是强酸,所以反应后的溶液中,c(A-)=
×0.01mol?L-1=0.005mol?L-1,故c(M+)+c(MOH)=2c(A-);
根据电荷守恒可得:c(H+)+c(M+)=c(A-)+c(OH-),
由c(M+)+c(MOH)=0.01mol/L,可得c(M+)=0.01mol/L-c(MOH),带入电荷守恒公式可得:c(H+)+0.01mol/L-c(MOH)=c(A-)+c(OH-),
整理可得:c(MOH)+c(OH-)=c(H+)+0.01mol/L-c(A-)=10-10mol/L+0.01mol/L-0.005mol?L-1≈0.005mol?L-1,
故答案为:=;0.005.
故答案为:弱;
(2)MA属于强酸弱碱盐,水解显示酸性,M+离子结合水电离的氢氧根离子生成了MOH,水解离子方程式为:M++H2O?MOH+H+;水电离的氢氧根离子等于溶液中氢离子的浓度,即c(OH-)=1×10-5mol?L-1,
故答案为:M++H2O?MOH+H+;1×10-5;
(3)由于在K点,MOH的物质的量远远大于HA的物质的量,溶液显示碱性,所以溶液中浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+),
故答案为:c(M+)>c(A-)>c(OH-)>c(H+);
(4)K点时,加入的MOH的物质的量=0.02mol?L-1×0.1L=0.002mol,混合溶液的体积是0.2L,根据物料守恒知,c(M+)+c(MOH)=
| 0.002mol |
| 0.2L |
HA是强酸,所以反应后的溶液中,c(A-)=
| 1 |
| 2 |
根据电荷守恒可得:c(H+)+c(M+)=c(A-)+c(OH-),
由c(M+)+c(MOH)=0.01mol/L,可得c(M+)=0.01mol/L-c(MOH),带入电荷守恒公式可得:c(H+)+0.01mol/L-c(MOH)=c(A-)+c(OH-),
整理可得:c(MOH)+c(OH-)=c(H+)+0.01mol/L-c(A-)=10-10mol/L+0.01mol/L-0.005mol?L-1≈0.005mol?L-1,
故答案为:=;0.005.
点评:本题考查了弱电解质的电离、盐类的水解、溶液的稀释、离子浓度的大小比较等知识点,题目难度中等,注意掌握盐的水解原理及其应用方法,能够利用电荷守恒、物料守恒判断溶液中离子浓度大小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
危险化学品要在包装标签上印有警示性标志.氢氧化钠应选用的标志是 ( )
A、 |
B、 |
C、 |
D、 |
下列液体中,滴入水中会出现分层现象,但在滴入热的氢氧化钠溶液中时分层现象会逐渐消失的是(不考虑有机物的挥发)( )
| A、溴乙烷 | B、乙醇 |
| C、橄榄油 | D、苯乙烯 |
正丁烷和异丁烷互为同分异构体,下列关于它们的说法正确的是( )
| A、具有相似的化学性质 |
| B、具有相同的物理性质 |
| C、是不同的物质 |
| D、分子式相同,但分子内碳原子的连接方式不同 |
 X+CH2═CH-R
X+CH2═CH-R CH═CH-R+HX (X为卤素原子,R为取代基)经由Heck反应合成M(一种防晒剂)的路线如下:
CH═CH-R+HX (X为卤素原子,R为取代基)经由Heck反应合成M(一种防晒剂)的路线如下:
