题目内容
某些化学反应可用下式表示A+B→C+D+H2O;请回答下列问题(反应可以是固体之间的反应,也可以是在水溶液中进行的反应).
(1)若A为紫红色金属,D为有色气体.则B为 (填化学式下同).反应的离子方程式为 .
(2)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌.反应的化学方程式为 .
(3)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊.相关反应的化学方程式为 .
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,D为正盐.则C为 .反应的离子方程式为 .
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色.实验室常用此反应制备C气体.反应的化学方程式为 .测得用排空气法收集到一烧瓶C气体的质量是相同状况下相同体积的H2质量的11倍,若用该烧瓶中C气体做喷泉实验,实验完毕后,烧瓶中水约上升到烧瓶容积的 .(填“几分之几”)
(1)若A为紫红色金属,D为有色气体.则B为
(2)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌.反应的化学方程式为
(3)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊.相关反应的化学方程式为
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,D为正盐.则C为
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色.实验室常用此反应制备C气体.反应的化学方程式为
考点:无机物的推断
专题:
分析:(1)若A为紫红色金属,则A为Cu,D为有色气体,该反应为Cu与浓硝酸反应;
(2)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌,则该反应是氯气与氢氧化钠的反应;
(3)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊,C、D分别为CO2、SO2中的一种,则该反应为碳与浓硫酸反应;
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,为CaCO3,D为正盐,应是碳酸氢钙与氢氧化钠反应生成碳酸钙、碳酸钠与水;
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色,实验室常用此反应制备C气体,则C为NH3,该反应为氢氧化钙与氯化铵反应生成氯化钙、氨气与水.
(2)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌,则该反应是氯气与氢氧化钠的反应;
(3)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊,C、D分别为CO2、SO2中的一种,则该反应为碳与浓硫酸反应;
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,为CaCO3,D为正盐,应是碳酸氢钙与氢氧化钠反应生成碳酸钙、碳酸钠与水;
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色,实验室常用此反应制备C气体,则C为NH3,该反应为氢氧化钙与氯化铵反应生成氯化钙、氨气与水.
解答:
解:(1)若A为紫红色金属,则A为Cu,D为有色气体,该反应为Cu与浓硝酸反应,B为浓硝酸、D为二氧化氮,反应离子方程式为:Cu+4H++2NO3-=Cu2++2H2O+2NO2↑,
故答案为:HNO3;Cu+4H++2NO3-=Cu2++2H2O+2NO2↑;
(2)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌,该反应是氯气与氢氧化钠的反应,则A为Cl2,该反应化学方程式为:2NaOH+Cl2=NaCl+NaClO+H2O,
故答案为:2NaOH+Cl2=NaCl+NaClO+H2O;
(3)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊,C、D分别为CO2、SO2中的一种,则该反应为碳与浓硫酸反应,故A为C,反应化学方程式为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,为CaCO3,D为正盐,应是碳酸氢钙与氢氧化钠反应生成碳酸钙、碳酸钠与水,反应离子方程式为:2OH-+Ca2++2HCO3-=2H2O+CaCO3↓+CO32-,
故答案为:CaCO3;2OH-+Ca2++2HCO3-=2H2O+CaCO3↓+CO32-;
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色,实验室常用此反应制备C气体,则C为NH3,该反应为氢氧化钙与氯化铵反应生成氯化钙、氨气与水,反应化学方程式为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O↑,
测得用排空气法收集到一烧瓶氨气的质量是相同状况下相同体积的H2质量的11倍,则混合气体评价相对分子质量为22,由十字交叉法可知,氨气与氢气的体积之比为(29-22):(22-17)=7:5,若用该烧瓶中氨气做喷泉实验,实验完毕后,烧瓶中水的体积等于氨气的体积,故烧瓶中水约上升到烧瓶容积的
=
,
故答案为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O↑;
.
故答案为:HNO3;Cu+4H++2NO3-=Cu2++2H2O+2NO2↑;
(2)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌,该反应是氯气与氢氧化钠的反应,则A为Cl2,该反应化学方程式为:2NaOH+Cl2=NaCl+NaClO+H2O,
故答案为:2NaOH+Cl2=NaCl+NaClO+H2O;
(3)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊,C、D分别为CO2、SO2中的一种,则该反应为碳与浓硫酸反应,故A为C,反应化学方程式为:C+2H2SO4(浓)
| ||
故答案为:C+2H2SO4(浓)
| ||
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,为CaCO3,D为正盐,应是碳酸氢钙与氢氧化钠反应生成碳酸钙、碳酸钠与水,反应离子方程式为:2OH-+Ca2++2HCO3-=2H2O+CaCO3↓+CO32-,
故答案为:CaCO3;2OH-+Ca2++2HCO3-=2H2O+CaCO3↓+CO32-;
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色,实验室常用此反应制备C气体,则C为NH3,该反应为氢氧化钙与氯化铵反应生成氯化钙、氨气与水,反应化学方程式为:Ca(OH)2+2NH4Cl
| ||
测得用排空气法收集到一烧瓶氨气的质量是相同状况下相同体积的H2质量的11倍,则混合气体评价相对分子质量为22,由十字交叉法可知,氨气与氢气的体积之比为(29-22):(22-17)=7:5,若用该烧瓶中氨气做喷泉实验,实验完毕后,烧瓶中水的体积等于氨气的体积,故烧瓶中水约上升到烧瓶容积的
| 7 |
| 7+5 |
| 7 |
| 12 |
故答案为:Ca(OH)2+2NH4Cl
| ||
| 7 |
| 12 |
点评:本题考查无机物推断,题目比较综合,需要学生熟练掌握元素化合物知识,难度中等.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
下列说法不正确的是( )
| A、振荡分液漏斗时应关闭其玻璃塞和活塞 |
| B、工业酒精的提纯实验中,冷凝管中冷凝水的流向与热气体的方向相反 |
| C、实验室制备乙烯时,温度计的水银球置于混合溶液上方,测气体的温度 |
| D、将含有 CaSO4的水垢用Na2CO3溶液处理,然后用酸可以除去 |
表明金属甲比金属乙活动性强的叙述正确的是( )
| A、在氧化还原反应中,甲失的电子比乙多 |
| B、将甲和乙用导线相连接,一同放入CuSO4溶液中,乙的表面有红色的铜析出 |
| C、同价态阳离子,甲比乙氧化性强 |
| D、将甲、乙组成原电池时,甲为正极 |
 前不久,各大媒体在显著的位置刊登了关于900t致癌大米的报道,主要是变质大米中存在的黄曲霉素使人体中的特殊基因发生突变,有转变成肝癌的可能性.它的结构如图所示,和l mol该化合物起反应的H2或NaOH的最大值分别是( )
前不久,各大媒体在显著的位置刊登了关于900t致癌大米的报道,主要是变质大米中存在的黄曲霉素使人体中的特殊基因发生突变,有转变成肝癌的可能性.它的结构如图所示,和l mol该化合物起反应的H2或NaOH的最大值分别是( )| A、5 mol,2 mol |
| B、7 mol,2 mol |
| C、6 mol,1 mol |
| D、7 mol,1 mol |
在一个恒容的密闭容器中进行如下反应:2SO2(g)+O2(g)?2SO3(g),已知反应过程中某一时刻SO2、SO3、O2的浓度分别为0.2mol/L、0.2mol/L、0.1mol/L,当该反应达到平衡时下列数据可能的是( )
| A、c(SO2)=0.4mol/L |
| B、c(SO2)=c(SO3)=0.15mol/L |
| C、c(SO2)=0.25mol/L |
| D、c(SO3)=0.4mol/L |

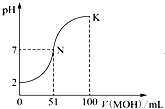 常温下向100mL 0.01mol?L-1 HA溶液中逐滴加入0.02mol?L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下向100mL 0.01mol?L-1 HA溶液中逐滴加入0.02mol?L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题: 和
和