题目内容
2.下列叙述正确的是( )| A. | 单质分子中不一定存在化学键 | |
| B. | 离子化合物中只含离子键,不含共价键 | |
| C. | 共价化合物一定含共价键,可能含离子键 | |
| D. | 非金属元素组成的化合物不存在离子键 |
分析 A、稀有气体分子中不含任何化学键;
B、离子化合物中可能含共价键,如NaOH;
C、共价化合物中只含共价键;
D、氯化铵是非金属元素形成的离子化合物.
解答 解:A、稀有气体分子中不含任何化学键,所以单质分子中不一定存在化学键,故A正确;
B、离子化合物中可能含共价键,如NaOH,故B错误;
C、共价化合物中只含共价键,不含离子键,故C错误;
D、氯化铵是非金属元素形成的离子化合物,所以可能存在离子键,故D错误;
故选A.
点评 本题主要考查学生对化学键、共价化合物、离子化合物等概念及其相互关系的理解,离子化合物中可能含共价键,但共价化合物中一定不含离子键.

练习册系列答案
相关题目
12.元素性质呈周期性变化的决定因素是( )
| A. | 元素原子半径大小呈周期性变化 | |
| B. | 元素原子量依次递增 | |
| C. | 元素原子核外电子排布呈周期性变化 | |
| D. | 元素的最高正化合价呈周期性变化 |
13.以下转化能通过一步反应实现的是( )
| A. | Al2O3→Al(OH)3 | B. | Al→Na[Al (OH)4] | C. | Fe→Fe(OH)2 | D. | SiO2→H2SiO3 |
14.2008年,我国的航天事业取得了巨大的成就,航天员翟志刚顺利实现了太空行走.下列说法不正确的是( )
| A. | 在生活舱中,可用过氧化钠制备氧气 | |
| B. | 金属镁可用作制造飞机、火箭的重要材料 | |
| C. | 在航天试验用的仪器仪表中大量使用了硅等非金属材料 | |
| D. | 返回舱外层的隔热瓦使用的是金属材料 |
14.有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用,如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物.下列说法中正确的是( )
| A. | 34S原子核内的中子数为16 | B. | 13C和15N原子核内的质子数相差1 | ||
| C. | 13C18O的摩尔质量为31 | D. | 2H+的酸性比1H+的酸性更强 |
 在如图装置中,Zn为负极,电极反应式为Zn-2e-═Zn2+,Cu电极的电极反应式为Cu2++2e-═Cu;盐桥(含KCl饱和溶液)中移向左边烧杯的离子为氯离子,电流从Zn极(填“Cu”或者“Zn”)流出.
在如图装置中,Zn为负极,电极反应式为Zn-2e-═Zn2+,Cu电极的电极反应式为Cu2++2e-═Cu;盐桥(含KCl饱和溶液)中移向左边烧杯的离子为氯离子,电流从Zn极(填“Cu”或者“Zn”)流出.
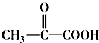 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$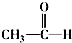 +CO2↑
+CO2↑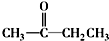 $→_{△}^{NaOHaq}$
$→_{△}^{NaOHaq}$ +H2O
+H2O .
.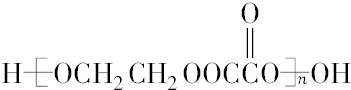 .
.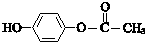 .
.