题目内容
17.制备1L含氨10%的氨水(密度是0.96g mL-1),需要标准状况下的氨气多少升?分析 先根据m=ρV计算溶液的质量,进而计算溶质的质量,再根据V=$\frac{m}{M}$×Vm计算.
解答 解:1L含氨10%的氨水的质量为1 L×1 000 mL•L-1×0.96 g•mL-1,由于氨水中的溶质均可看成氨分子,
则氨气的质量为1 L×1 000 mL•L-1×0.96 g•mL-1×10%=96g,标准状况下的氨气的体积V(NH3)=$\frac{96g}{17g/mol}$×222.4L/mol=126.5L;
答:需要标准状况下的氨气126.5L.
点评 本题主要考查质量分数的有关计算,难度不大,注意氨水中溶质为氨气,注意对质量分数的理解.

练习册系列答案
相关题目
8.下列关叙述正确的是( )
| A. | 橡胶一定属于合成材料 | |
| B. | 豆油、花生油、牛油都属于酯类 | |
| C. | 区别植物油、矿物油可以加水后振荡,观察其是否分层 | |
| D. | 1 mol乙醇与足量的钠反应可以生成3 mol的氢气 |
5.下列有关分子结构与性质的叙述中正确的是( )
| A. | CS2、H2O、C2H2都是直线形分子 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | CH2=CH2和CH≡CH分子中含有的π键个数相等 | |
| D. | CH4、CCl4、SiH4都是含有极性键的非极性分子 |
2.下列叙述正确的是( )
| A. | 单质分子中不一定存在化学键 | |
| B. | 离子化合物中只含离子键,不含共价键 | |
| C. | 共价化合物一定含共价键,可能含离子键 | |
| D. | 非金属元素组成的化合物不存在离子键 |
9.实验室在没有浓盐酸情况下,常用浓硫酸、食盐和二氧化锰在加热条件下制取氯气,反应方程式为:2NaCl+3H2SO4(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$2NaHSO4+MnSO4+Cl2↑+2H2O.某研究性学习小组在查阅相关资料时发现二氧化锰与浓硫酸在加热条件下可产生氧气,反应方程式为:2MnO2+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2MnSO4+O2↑+2H2O.

(1)请从上图中选用所需的仪器(仪器可重复使用)组成一套验证氯水的酸性、氧化性及漂白性的实验装置,同时证明制氯气过程中产生了O2.现提供以下药品:MnO2、浓硫酸、食盐、石蕊试液、酚酞试液、淀粉-KI溶液、碱石灰、蒸馏水.将所用仪器的序号按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称或化学式(划横线部分不需要填写).
证明有氧气生成的操作及现象是把D中的导管移出水面,关闭分液漏斗活塞,撤走酒精灯,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管内,木条复燃,证明试管中收集的气体是氧气.
(2)实验持续进行过程中,观察到装有紫色石蕊试液的洗气瓶中的颜色变化是紫色→红色→无色→黄绿色.
(3)实验中观察到装有淀粉-KI溶液的洗气瓶中溶液的颜色由无色变蓝色,最后褪色.经测定碘最终被氧化成+5价,且溶液呈强酸性.写出有关溶液颜色变化的化学反应方程式Cl2+2KI=I2+2KCl,5Cl2+I2+6H2O=2HIO3+10HCl.

(1)请从上图中选用所需的仪器(仪器可重复使用)组成一套验证氯水的酸性、氧化性及漂白性的实验装置,同时证明制氯气过程中产生了O2.现提供以下药品:MnO2、浓硫酸、食盐、石蕊试液、酚酞试液、淀粉-KI溶液、碱石灰、蒸馏水.将所用仪器的序号按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称或化学式(划横线部分不需要填写).
| 选用的仪器 | 加入的试剂 |
| A | 二氧化锰、浓硫酸、食盐 |
| D | -- |
(2)实验持续进行过程中,观察到装有紫色石蕊试液的洗气瓶中的颜色变化是紫色→红色→无色→黄绿色.
(3)实验中观察到装有淀粉-KI溶液的洗气瓶中溶液的颜色由无色变蓝色,最后褪色.经测定碘最终被氧化成+5价,且溶液呈强酸性.写出有关溶液颜色变化的化学反应方程式Cl2+2KI=I2+2KCl,5Cl2+I2+6H2O=2HIO3+10HCl.
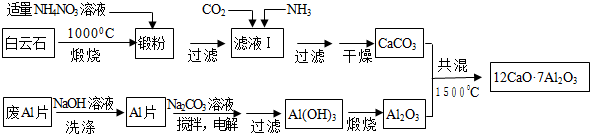

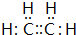 ;C的分子式:C2H4O;D中的官能团:羧基.
;C的分子式:C2H4O;D中的官能团:羧基. .
.