题目内容
18.有Na2SO4、Fe2(SO4)3的混合溶液,已知其中Fe3+的物质的量浓度为0.3mol•L-1,SO42-的物质的量浓度为0.6mol•L-1,则此溶液中Na+的物质的量浓度为( )| A. | 0.1 mol•L-1 | B. | 0.3 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.25 mol•L-1 |
分析 溶液呈电中性,根据电荷守恒有3c(Fe3+)+c(Na+)=2c(SO42-),据此计算.
解答 解:溶液呈电中性,根据电荷守恒有3c(Fe3+)+c(Na+)=2c(SO42-),则:
0.3mol/L×3+c(Na+)=2×0.6mol/L
解得:c(Na+)=0.3mol/L,
故选B.
点评 考查物质的量浓度的有关计算,难度中等,电解质混合溶液中离子浓度的计算经常利用电荷守恒计算.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
9.下列关于钠的叙述,正确的是( )
①钠与水反应时浮于水面且小球状游动 ②钠可以保存在四氯化碳中③钠元素在自然界中只能以化合态形式存在 ④钠可从硫酸铜溶液中置换出铜⑤金属钠只有还原性而没有氧化性.
①钠与水反应时浮于水面且小球状游动 ②钠可以保存在四氯化碳中③钠元素在自然界中只能以化合态形式存在 ④钠可从硫酸铜溶液中置换出铜⑤金属钠只有还原性而没有氧化性.
| A. | ①②③ | B. | ③④⑤ | C. | ②③⑤ | D. | ①③⑤ |
3.下列有关气体摩尔体积的描述中正确的是( )
| A. | 气体摩尔体积为22.4 L•mol-1 | |
| B. | 1 mol O2的质量是32 g,它所占的体积是22.4 L | |
| C. | 标准状况下,1 mol任何物质的体积均约为22.4 L | |
| D. | 标准状况下,6.02×1023个CO分子的体积约为22.4 L |
10.美国通用原子能公司(GA)提出的碘硫热化学循环是由反应Ⅰ、Ⅱ、Ⅲ三步反应组成的(如图所示),下列有关说法正确的是( )


| A. | 设计该循环是为了制取能源气体O2 | |
| B. | 整个循环过程中产生1 mol O2的同时产生44.8 L H2 | |
| C. | 图中反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 | |
| D. | 图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行 |
7.下列离子检验的方法正确的是( )
| A. | 向某溶液中加入少量硝酸银溶液,生成白色沉淀,说明原溶液中有Cl- | |
| B. | 向某溶液中加入少量氯化钡溶液,生成白色沉淀,说明原溶液中有SO42- | |
| C. | 向某溶液中加入少量氢氧化钙溶液,生成白色沉淀,说明原溶液中有CO32- | |
| D. | 向某溶液中加入足量盐酸,无现象,再加入少量BaCl2溶液,产生白色沉淀,说明原溶液中有SO42- |
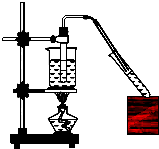 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯.