题目内容
5.某有机物分子式为C2H6O2,该有机物1mol与足量金属钠反应,生成22.4L的H2(标准状况下),已知结构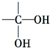 不稳定,则该有机物的结构简式为HOCH2CH2OH.
不稳定,则该有机物的结构简式为HOCH2CH2OH.
分析 由分子式为C2H6O2,可知含有羟基或醚键,该有机物1mol与足量金属钠反应,生成22.4L的H2(标准状况下),说明含有2个羟基,从而书写结构简式.
解答 解:由分子式为C2H6O2,可知含有羟基或醚键,该有机物1mol与足量金属钠反应,生成22.4L的H2(标准状况下),说明含有2个羟基,结构简式为:HOCH2CH2OH,故答案为:HOCH2CH2OH.
点评 本题主要考查了同分异构体的书写,准确判断官能团的种类与数目是解题的关键,难度不大.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
15.下列关于乙烯的结构或性质正确的是( )
| A. | 不能使酸性高锰酸钾溶液褪色 | B. | 不能在空气中燃烧 | ||
| C. | 乙烯中所有原子都在同一个平面上 | D. | 光照条件下与氯气发生取代反应 |
16.下列有关性质的比较,不正确的是( )
| A. | 酸性强弱:HI>HBr>HCl | B. | 非金属性:O>S>Se | ||
| C. | 还原性强弱:F->Cl->I- | D. | 碱性强弱:KOH>NaOH>LiOH |
20.我国古代有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe+CuSO4═Cu+FeSO4.下列有关说法不正确的是( )
| A. | 该反应属于置换反应 | |
| B. | 若铁粉过量,充分反应后溶液由蓝色变为棕黄色 | |
| C. | CuSO4具有氧化性 | |
| D. | 转移0.2mol电子,则固体质量增加了0.8g |
10.下列离子与氖原子具有相同核外电子数的有( )
| A. | Mg2+ | B. | O2- | C. | Al3+ | D. | S2- |
17.下面表格中的实验操作、实验现象和结论均正确且相符的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸只表现脱水性 |
| B | 将盐酸滴入Na2CO3溶液中 | 有气泡产生 | 氯的非金属性比碳强 |
| C | 向某溶液中加入浓NaOH溶液并加热, 在试管口用湿润的红色石蕊试纸检验 | 试纸变蓝 | 原溶液中含有NH4+ |
| D | SO2通入品红溶液中 | 溶液褪色 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
4.用中和滴定法测定某烧碱样品的纯度.有以下步骤:
(1)配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要用到的主要仪器有1000mL容量瓶,胶头滴管;
(2)滴定过程:
①盛装0.10mol/L的盐酸标准液应该使用酸滴定管;
②滴定时双眼应注意观察注意观察锥形瓶内溶液颜色的变化;
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,测定结果偏低;
④装标准液之前,没有用标准液润洗滴定管,测定结果偏高;
(4)有关数据记录如下:
计算纯度:烧碱样品的纯度是80.8%(取两次实验所耗盐酸的平均值进行计算,不写计算过程)
(1)配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要用到的主要仪器有1000mL容量瓶,胶头滴管;
(2)滴定过程:
①盛装0.10mol/L的盐酸标准液应该使用酸滴定管;
②滴定时双眼应注意观察注意观察锥形瓶内溶液颜色的变化;
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,测定结果偏低;
④装标准液之前,没有用标准液润洗滴定管,测定结果偏高;
(4)有关数据记录如下:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |