题目内容
13.某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹).
(1)甲、乙两仪器的名称是分液漏斗、圆底烧瓶.
(2)利用B装置可制取的气体有H2、NO、CO2、H2S等(写出两种即可).
(3)A、C、E相连后的装置可用于制取Cl2,写出A中发生反应的化学方程式4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O.
(4)B、D、E装置相连后,在B中盛装浓硝酸和铜片(铜片放在有孔塑料板上),可制得NO 2并进行有关实验.
①欲用D装置验证NO 2与水的反应,其操作步骤为:先关闭止水夹a、b,再打开止水夹c,使烧杯中的水进入试管丁中.
②试管丁中的NO 2与水充分反应后,若向试管内缓缓通入一定量的O 2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是0.045mol•L - 1(保留2位有效数值,气体按标准状况计算).
分析 (1)依据装置图形状和用途分析仪器名称;
(2)根据装置图可以看出,在不加热的条件下固体和液体反应制备气体,当将装置中的导气管关闭后,生成的气体使装置中的气压增大,从而使固体和液体分离,使反应停止,该装置具备随制随停的特点,据此即可解答;
(3)A、C、E相连后的装置可用于制取Cl2,装置A为发生装置是二氧化锰固体和浓盐酸加热反应生成氯气,装置C是收集氯气,装置E是吸收剩余氯气;
(4)①根据二氧化氮溶于水形成压强差分析;
②先根据二氧化氮的体积计算硝酸的物质的量,再根据C=$\frac{n(HN{O}_{3})}{V}$计算溶液的浓度.
解答 解:(1)甲的名称为分液漏斗,乙的名称是圆底烧瓶,
故答案为:分液漏斗、圆底烧瓶;
(2)该装置的最大特点是可以控制反应的发生和停止,药品一般是固体和液体在常温下能反应,实验室用锌和稀硫酸制取氢气,Zn+H2SO4=ZnSO4+H2↑,锌难溶于水,氢气难溶于水,当将装置中的导气管关闭后,生成的H2使装置中的气压增大,从而使固体和液体分离,使反应停止,所以能用图中的装置制取氢气;金属铜能稀硝酸在常温下发生反应生成硝酸铜、一氧化氮和水,即3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,属于固体和液体混合反应不需要加热的反应,所以能用图中的装置制备,二氧化碳、硫化氢也是固体和液体不加热反应制备,CaCO3+2HCl=CaCl2+CO2↑+H2O,FeS+2HCl=FeCl2+H2S↑
故答案为:H2、NO、CO2、H2S等;
(3)A、C、E相连后的装置可用于制取Cl2,装置A为发生装置是二氧化锰固体和浓盐酸加热反应生成氯气,反应的化学方程式为:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,
故答案为;4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
(4)①若二氧化氮能和水反应,则烧杯内气体的压强会减小,小于外界大气压,烧杯中的溶液会倒流于试管丁,所以先关闭止水夹 ab再打开止水夹 c,使烧杯中的水进入试管丁.
故答案为:ab;c;
③设容器的体积为VL,所以二氧化氮气体的物质的量为n=$\frac{VL}{22.4L/mol}$,二氧化氮和氧气、水反应生成硝酸,所以溶质是硝酸.
设生成硝酸的物质的量为xmol;
4NO2 +O2 +2H2O=4HNO3
4mol 4mol
$\frac{VL}{22.4L/mol}$ xmol
解得:x=$\frac{VL}{22.4L/mol}$
硝酸的物质的量浓度是C=$\frac{n(HN{O}_{3})}{V}$=$\frac{\frac{VL}{22.4L/mol}}{VL}$=0.045mol/L;
故答案为:0.045.
点评 本题考查较为综合,题目难度中等,注意实验室制备气体的实验装置和反应原理,把握物质的主要性质,注重基础知识的积累.

| A. | 用水润湿的pH试纸来测量溶液的pH | |
| B. | 实验室需要480 mL 2.0 mol•L -1的氢氧化钠溶液,配制该溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、移液、洗涤、定容、摇匀的步骤进行操作 | |
| C. | 用溴水、淀粉-KI溶液比较Br2与I2的氧化性强弱,所需玻璃仪器主要有:试管、胶头滴管 | |
| D. | 向溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
| A. | 稀硝酸 | B. | 硫酸 | C. | 氨水 | D. | 氢氧化钠 |
| A. | CaH2和Na2S | B. | Na2O和Na2O2 | C. | NaOH和CaO | D. | H2O2和CO2 |
| A. | 苯与溴水充分振荡后,溴水层褪色说明苯分子中的碳原子没有饱和 | |
| B. |  的最简式相同 的最简式相同 | |
| C. | 苯分子是环状结构,只有6个碳原子在同一平面上 | |
| D. | 苯的邻位二元取代物只有一种可以说明苯分予不具有碳碳单键和碳碳双键的交替结构 |

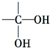 不稳定,则该有机物的结构简式为HOCH2CH2OH.
不稳定,则该有机物的结构简式为HOCH2CH2OH.