题目内容
15.下列关于乙烯的结构或性质正确的是( )| A. | 不能使酸性高锰酸钾溶液褪色 | B. | 不能在空气中燃烧 | ||
| C. | 乙烯中所有原子都在同一个平面上 | D. | 光照条件下与氯气发生取代反应 |
分析 A.碳碳双键较活泼,能被酸性高锰酸钾溶液氧化;
B.烯烃都能燃烧生成碳氧化物和水;
C.乙烯是平面结构;
D.乙烯能和氯气在一定条件下发生加成反应.
解答 解:A.碳碳双键较活泼,能被酸性高锰酸钾溶液氧化,乙烯中含有碳碳双键,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,该反应是氧化反应,故A错误;
B.烯烃都能燃烧生成碳氧化物和水,所以乙烯在空气中能燃烧,如果完全燃烧则生成二氧化碳和水,故B错误;
C.乙烯是平面结构,所以乙烯中所有原子都在同一个平面上,故C正确;
D.乙烯能和氯气在一定条件下发生加成反应,乙烯和氯气在光照条件下不反应,故D错误;
故选C.
点评 本题考查乙烯结构和性质,为高频考点,明确乙烯空间结构及性质是解本题关键,碳碳双键能发生加成反应、加聚反应和氧化反应,注意A发生的是氧化反应而不是加成反应,为易错点.

练习册系列答案
相关题目
5.下列关于周期表中第三周期元素性质从左到右变化趋势的叙述,错误的是( )
| A. | 最高正价依次升高 | |
| B. | 气态氢化物稳定性逐渐增强 | |
| C. | 原子半径逐渐增大 | |
| D. | 最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强 |
6.Mg-AgCl电池是一种用海水激活的一次电池,在军事上用作电动鱼雷的电源.电池的总反应可表示为:Mg+2AgCl=MgCl2+2Ag,下列关于该电池的说法错误的是( )
| A. | 该电池工作时,正极发生还原反应 | |
| B. | 该电池的负极材料可以用金属铝代替 | |
| C. | 有1mol Mg被氧化时,可还原得到108g Ag | |
| D. | 装备该电池的鱼雷在水中进行时,海水作为电解质溶液 |
10.4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性.
回答下列问题:
(1)4种元素原子半径由大到小的顺序是(写元素符号)Mg>Al>C>N.
(2)元素m的一种核素可测定文物年代,这种核素的符号是${\;}_{6}^{14}$C.
(3)元素y单质可采用电解熔融Al2O3的方法制备.
(4)元素m与氢元素(H)能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)C2H2.
(5)用电子式表示化合物xCl2的形成过程 .
.
(6)气体分子(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaCNO+H2O.
回答下列问题:
| m | n | ||
| x | y |
(2)元素m的一种核素可测定文物年代,这种核素的符号是${\;}_{6}^{14}$C.
(3)元素y单质可采用电解熔融Al2O3的方法制备.
(4)元素m与氢元素(H)能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)C2H2.
(5)用电子式表示化合物xCl2的形成过程
 .
.(6)气体分子(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaCNO+H2O.
7.某气态烃0.5mol恰好与1molHCl了加成,1mol生成物又可与3mol Cl2发生取代反应,则此烃可能是( )
| A. | C2H2 | B. | CH2=CHCH=CH2 | C. | CH≡C-CH3 | D. | CH≡C-CH2-CH3 |
 反应类型取代反应.
反应类型取代反应.
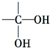 不稳定,则该有机物的结构简式为HOCH2CH2OH.
不稳定,则该有机物的结构简式为HOCH2CH2OH.