题目内容
7. 铁和铝是日常生活中用途广泛的金属.
铁和铝是日常生活中用途广泛的金属.I.(1)向NaAlO2溶液中滴加AlCl3溶液,生成白色胶状沉淀,则发生反应的离子方程式为3AlO2-+Al3++6H2O=4Al(OH)3↓.
(2)实验室常用还原性 Fe 粉与水蒸气反应的实验来研究 Fe 的还原性,则该反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(3)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:2Fe3++Cu=2Fe2++Cu2+.
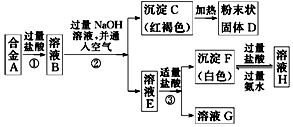
II.已知合金A由两种常见金属组成.为测定其组成,某同学的实验流程如图所示:请回答:
(4)溶液E中所含的溶质是NaAlO2、NaOH、NaCl(写化学式)
(5)合金A中的一种金属可以与粉末状固体D在高温下反应生成合金A中的另一种金属,请写出该反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
分析 I.(1)向NaAlO2溶液中滴加AlCl3溶液,生成白色胶状沉淀,相互促进水解生成氢氧化铝沉淀;
(2)Fe 粉与水蒸气反应生成四氧化三铁和氢气;
(3)FeCl3溶液与铜反应生成氯化铜、氯化亚铁;
II.合金A由两种常见金属组成,由流程可知,加入过量盐酸反应得到溶液B,加入过量氢氧化钠溶液并通入空气时,过滤得到红褐色沉淀,可知C为Fe(OH)3,加热分解得到粉末状固体D为Fe2O3,则确定合金含Fe,滤液E加入适量量盐酸生成白色沉淀F和溶液G,白色沉淀F加入过量盐酸溶解得到溶液H,溶液H加入过量氨水又生成白色沉淀F,确定白色沉淀F为Al(OH)3沉淀,溶液H为过量盐酸和AlCl3溶液,溶液G含NaCl,溶液E含NaCl、NaOH、NaAlO2,溶液B为氯化亚铁和氯化铝的混合溶液,合金中含金属为Fe、Al,以此来解答.
解答 解:I.(1)向NaAlO2溶液中滴加AlCl3溶液,生成白色胶状沉淀,相互促进水解生成氢氧化铝沉淀,离子反应为3AlO2-+Al3++6H2O=4Al(OH)3↓,
故答案为:3AlO2-+Al3++6H2O=4Al(OH)3↓;
(2)Fe 粉与水蒸气反应生成四氧化三铁和氢气,化学反应方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)FeCl3溶液与铜反应生成氯化铜、氯化亚铁,离子反应为2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;
II.合金A由两种常见金属组成,由流程可知,加入过量盐酸反应得到溶液B,加入过量氢氧化钠溶液并通入空气时,过滤得到红褐色沉淀,可知C为Fe(OH)3,加热分解得到粉末状固体D为Fe2O3,则确定合金含Fe,滤液E加入适量量盐酸生成白色沉淀F和溶液G,白色沉淀F加入过量盐酸溶解得到溶液H,溶液H加入过量氨水又生成白色沉淀F,确定白色沉淀F为Al(OH)3沉淀,溶液H为过量盐酸和AlCl3溶液,溶液G含NaCl,溶液E含NaCl、NaOH、NaAlO2,溶液B为氯化亚铁和氯化铝的混合溶液,合金中含金属为Fe、Al,
(4)由上述分析可知,E中所含溶质为NaAlO2、NaOH、NaCl,故答案为:NaAlO2、NaOH、NaCl;
(5)Al可与氧化铁发生铝热反应,则反应为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、流程中试剂的量、混合物分离提纯方法为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案| A. | 多糖水解可以生成乙醇,故可用玉米、秸秆等为原料制取乙醇 | |
| B. | 葡萄糖是醛糖,果糖是酮糖,但不能用银镜反应来区分葡萄糖和果糖 | |
| C. | 油脂在碱性条件下水解生成甘油和髙级脂肪酸,此反应又称皂化反应 | |
| D. | 鉴别蚕丝、纯神、涤纶可采用灼烧闻气味的方法,涤纶灼烧时有烧焦羽毛的气味 |
| A. | 该晶体类型是原子晶体 | |
| B. | 晶体中碳原子数与C-O化学键数之比为1:2 | |
| C. | 晶体的空间最小环共有6个原子构成 | |
| D. | 该晶体中碳原子和氧原子的个数比为1:2 |
| A. | 44gC3H8中含有的非极性键数为2NA | |
| B. | 在常温常压下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数为0.3NA | |
| C. | 200 mL 1 mol/L Al2(SO4)3溶液中,Al3+和SO42-离子数的总和小于NA | |
| D. | O2和O3的混合物共6.4g,其中所含氧原子数一定为0.4 NA |
| A. | 将少量浓氨水滴入Al2(SO)4溶液 将少量Al2(SO4)3溶液滴入浓氨水 | |
| B. | 将少量SO2通入Ba(OH)2溶液 将过量SO2通入少量Ba(OH)2溶液 | |
| C. | 将0.1molCl2通入含0.2molFeBr2的溶液中 将0.3molCl2通入含0.2molFeBr2溶液 | |
| D. | 将过量BaCl2溶液与少量Na2SO4溶液相混合 将少量Ba(OH)2溶液与过量MgSO4溶液相混合 |
| A. | 向苯酚钠溶液中通入CO2可制得苯酚,并得到碳酸钠 | |
| B. | 将铁屑、溴水、苯混合可制得溴苯 | |
| C. | 实验时不小心沾到手上的苯酚可用氢氧化钠溶液洗掉 | |
| D. | 用醋酸溶液洗涤沾附在暖水瓶内壁上水垢的过程中发生了复分解反应 |
 氟的单质及其化合物在工农业生产中应用非常广泛.回答下列问题:
氟的单质及其化合物在工农业生产中应用非常广泛.回答下列问题:(1)基态氟原子的外围电子排布式为2s22p5,元素周期表中氟元素所在的区为p.
(2)电解NaHF2(氟化氢钠)可制氟气.NaHF2中所含作用力的类型有离子键、共价键、氢键,与HF2-互为等电子体的分子是CO2(或Na2O)(任写一种).
(3)OF2是一种氧化性极强的气体,其中氧原子的杂化轨道类型是sp3.
(4)部分氟化物的熔点和莫氏硬度的数据如表:
| 化合物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
| 莫氏硬度 | 3.2 | 6.0 | 无 |
②MgF2的莫氏硬度大于NaF的原因是MgF2和NaF都是离子晶体,它们的阴离子都是F-,而Mg2+的半径比Na+小,Mg2+所带电荷数比Na+多,则MgF2晶格能大于NaF,故MgF2的莫氏硬度大于NaF
(5)氟化钙的晶胞结构如图所示,晶胞参数a=0.555nm.
①Ca2+、F-的配位数分别为8、4.
②列式计算氟化钙晶体的密度:ρ=$\frac{4×78}{{N}_{A}•(5.55×1{0}^{-6})^{3}}$(不必计算出结果,用NA表示阿伏加德罗常数的数值)g•cm-3.
(供选择的试剂:①KSCN溶液②H2O2溶液③盐酸④酸性KMnO4溶液)
| A. | ①④ | B. | ③① | C. | ③②① | D. | ③①④ |
| A. |  利用图装置,可快速制取氨气 | |
| B. |  利用图装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液 | |
| C. |  利用图装置,可制取乙酸乙酯 | |
| D. |  利用图装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |