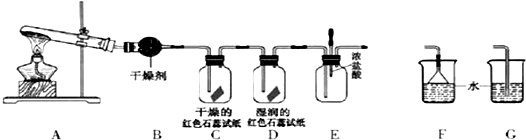
��Ŀ����
8��ij��ȤС������ϩ��Ϊ��Ҫԭ�Ϻϳ�ҩ����³����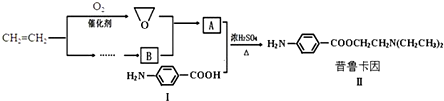
��֪��

��1��������³��������˵����ȷ����C��
A��һ����������11��̼ԭ�� B���������������ӳɷ�Ӧ C���ɷ���ˮ�ⷴӦ
��2���������ķ���ʽΪC7H7NO2��1mol�����������3mol H 2ǡ����ȫ��Ӧ��
��3�����������ŨH 2SO 4�ͼ��ȵ������£������ܷ�Ӧ���ɸ߷��Ӿۺ����д����Ľṹ��ʽ
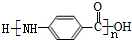 ��
����4�����û�ѧ��Ӧ����ʽ��ʾ����ϩΪԭ���Ʊ�B�����Լ���ѡ�����йط�Ӧ����ָ�������ķ�Ӧ����CH2=CH2+HCl$\stackrel{����}{��}$CH3CH2Cl ���ӳɷ�Ӧ����2CH3CH2Cl+NH3��HN��CH2CH3��2+2HCl ��ȡ����Ӧ����
���� ����³������������Ľṹ����֪AΪHOCH2CH2N��CH2CH3��2��BӦΪ��CH2CH3��2NH��
��1��A����³������Ӻ���13��̼ԭ�ӣ�
B�����б��������б������ʣ�
C�����������������������ʣ�
��2�����ݻ������Ľṹ��ʽ��д����ʽ�����������������ӳɷ�Ӧ��
��3������������Ȼ����������������۷�Ӧ���ɸ߾��
��4�������Ϣ��֪����ϩ��HCl�����ӳɷ�Ӧ����CH3CH2Cl��CH3CH2Cl���백������ȡ����Ӧ����HN��CH2CH3��2��
��� �⣺����³������������Ľṹ����֪AΪHOCH2CH2N��CH2CH3��2��BӦΪ��CH2CH3��2NH��
��1��A���ɽṹ��֪����³������Ӻ���13��̼ԭ�ӣ���A����
B�����б������������������ӳɷ�Ӧ����B����
C���������������Է���ˮ�ⷴӦ����C��ȷ��
�ʴ�Ϊ��C��
��2�����ݻ������Ľṹ��ʽ����֪�����ʽΪC7H7NO2�����������������ӳɷ�Ӧ��1mol������I����3mol���������ӳɷ�Ӧ��
�ʴ�Ϊ��C7H7NO2��3��
��3������������Ȼ����������������۷�Ӧ���ɸ߾����߾���ṹ��ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��4��������³����ͻ������Ľṹ��ʽ��֪��A�Ľṹ��ʽΪHOCH 2CH 2N��CH 2CH 3�� 2��B�뻷�����鷴Ӧ����A���������֪��Ϣ��֪��B�Ľṹ��ʽΪ��CH 2CH 3�� 2NH������CH 3CH 2Cl��NH 3��Ӧ���ɣ�����ϩΪԭ�ϣ���Ӧ�Ⱥ�HCl�ӳɣ�����CH 3CH 2Cl����ط�Ӧ�ķ���ʽΪCH 2=CH 2+HCl $\stackrel{����}{��}$CH 3CH 2Cl��2CH 3CH 2Cl+NH 3��HN��CH 2CH 3�� 2+2HCl��
�ʴ�Ϊ��CH2=CH2+HCl$\stackrel{����}{��}$CH3CH2Cl ���ӳɷ�Ӧ����2CH3CH2Cl+NH3��HN��CH2CH3��2+2HCl ��ȡ����Ӧ����
���� ���⿼���л����ƶ���ϳɡ��л���ṹ�����ʵȣ���Ŀ�Ѷ��еȣ������л���Ľṹ�����ƶϣ���4����ע��Է�Ӧ��Ϣ�����������ã�����������ѧ���ķ���������������������

 ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�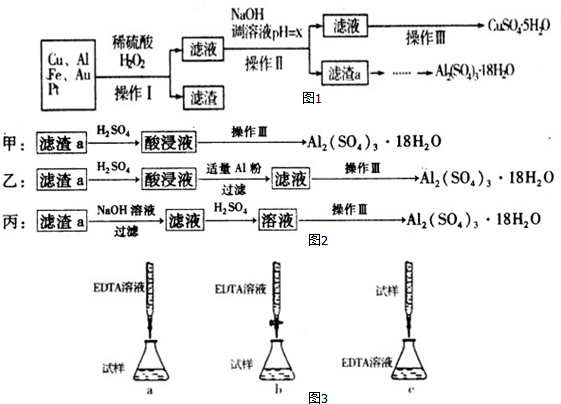
��֪������Ϣ��
Cu����ϡ�����H2O2�Ļ��Һ��Ӧ��������ͭ����������ͭ������������������ʽ����ʱ��Һ��pH�����
| ������ | Fe��OH��3 | Al��OH��3 | Cu��OH��2 |
| ��ʼ���� | 1.1 | 4.0 | 5.4 |
| ��ȫ���� | 3.2 | 5.2 | 6.7 |
��1�����������������Au��Pt_������
��2��д��Cu��ϡ�����H2O2�Ļ��Һ��Ӧ�����ӷ���ʽ��Cu+H2O2+2H+=Cu2++2H2O��
��3���ڲ������У�x��ȡֵ��Χ��5.2��x��5.4��
��4��������a��ȡAl2��SO4��3•l8H2O��̽��С���������ͼ2���ַ������ۺϿ����������ַ�������߿����Ե����ң�����ţ���
��5��Ϊ�ⶨCuSO4•5H2O����Ĵ��ȣ���������ʵ�飺ȡa g�������l00mL��Һ��ÿ��ȡ20.00mL�������������Ӻ���b mol•L-1EDTA��Na2H2Y������Һ�ζ����е�Cu2+�����ӷ���ʽΪCu2++H2Y2-=CuY2-+2H+�����ζ����յ㣬ƽ������EDTA��Һl2.00mL��������ʱ��5%��Na2H2Yˮ��Һ����pHΪ4-6����
��CuSO4•5H2O����Ĵ�����$\frac{15b}{a}$��100%��
����ͼ3�ζ���ʽ�У���������ǣ��гֲ�����ȥ��b������ţ���
 �Ҵ����ӽṹ�и���ѧ����ͼ��ʾ�������Ҵ��ڸ��ַ�Ӧ�ж��Ѽ���˵������ȷ���ǣ�������
�Ҵ����ӽṹ�и���ѧ����ͼ��ʾ�������Ҵ��ڸ��ַ�Ӧ�ж��Ѽ���˵������ȷ���ǣ�������| A�� | �ͽ����Ʒ�Ӧʱ���ٶ��� | |
| B�� | ��ŨH 2SO4���ȵ�170��ʱ�ϼ��ں͢� | |
| C�� | ��������������O2��Ӧʱ�ϼ��ٺ͢� | |
| D�� | ��ŨH 2SO4���ȵ�140��ʱ�ϼ��ڣ����������仯 |
| A�� | ���� | B�� | ������������ | C�� | ���� | D�� | ������̼ |
| A�� | ����մ��Ƥ���Ͽ�������������Һ��ϴ | |
| B�� | ���Ϳ��������ƻ�ױƷ | |
| C�� | ʹ��������������ڽ��ʹ����еĶ�����̼ | |
| D�� | ����̼����ָ���ú�̼���͵�������Ϊȼ�� |