题目内容
已知亚磷酸(H3PO3)为二元酸,室温下Ka1=5.0×10-3,Ka2=2.5×10-7;室温下NH3?H2O的电离常数Kb=1.8×10-5.氨水与亚磷酸发生中和反应可生成两种铵盐.NH4H2PO3中P元素的化合价为 ,该盐的水溶液呈 性.
考点:盐类水解的应用,常见元素的化合价
专题:盐类的水解专题
分析:根据化合价规则确定物质中元素的化合价;根据NH4H2PO3中阳离子和阴离子的水解平衡常数的大小来判断溶液的酸碱性.
解答:
解:NH4H2PO3中H是+1价,N是-3价,O是-2价,根据化合价规则,物质中P元素的化合价是+3价,根据水解平衡常数Kh=
得到:铵根离子水解平衡常数=
,磷酸二氢根离子的水解平衡常数=
,所以磷酸氢根离子的水解平衡常数Kh=
=
,所以磷酸二氢根离子的电离程度大于铵根离子水解程度,溶液显示酸性,
故答案为:+3;酸.
| Kw |
| K |
| 10-14 |
| 1.8×10-5 |
| 10-14 |
| 5×10-3 |
| Kw |
| K |
| 10-14 |
| 2.5×10-7 |
故答案为:+3;酸.
点评:本题考查学生化合价规则的使用以及电离和水解平衡常数的计算关系知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
如图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是?( )


| A、非金属性:Y>Z>M |
| B、原子半径:M>Z>Y |
| C、Z元素最高价氧化物的对应水化物的浓溶液具有强氧化性和不挥发性 |
| D、三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
当光束通过下列分散系:①有尘埃的空气 ②稀硫酸 ③水 ④墨水,能观察到丁达尔效应的是( )
| A、①② | B、③④ | C、①④ | D、②④ |
下列有关叙述正确的是( )
A、 如图装置所示,可准确测定中和热 如图装置所示,可准确测定中和热 |
| B、若用50mL 0.55mo1?L-1的氢氧化钠溶液,分别与50mL 0.50mo1?L-1的盐酸和50mL0.50mo1?L-1的硫酸充分反应,两反应测定的中和热不相等 |
| C、在中和滴定实验中,滴定管用蒸馏水洗涤后,再用标准液润洗,再加进标准液 |
| D、进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化 |



 为测定某种碱金属的相对原子质量,设计了如图所示的装置,该装置(包括水)的总质量为ag,将质量为bg(不足量)的碱金属放入水中.立即塞紧瓶塞,完全反应后,此装置的总质量为cg.则:
为测定某种碱金属的相对原子质量,设计了如图所示的装置,该装置(包括水)的总质量为ag,将质量为bg(不足量)的碱金属放入水中.立即塞紧瓶塞,完全反应后,此装置的总质量为cg.则: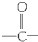 )的化合物
)的化合物 (R,R′代表烷基或H原子)发生缩合反应生成新的有机物和水,苯酚还可跟酰氯
(R,R′代表烷基或H原子)发生缩合反应生成新的有机物和水,苯酚还可跟酰氯 反应生成有机酸酯,例如
反应生成有机酸酯,例如

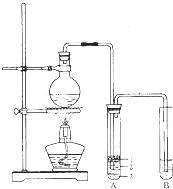 实验室制取少量溴乙烷所用试剂是乙醇和溴化氢反应;溴乙烷的密度比水大且不溶于水.实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷所用试剂是乙醇和溴化氢反应;溴乙烷的密度比水大且不溶于水.实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空: