题目内容
在标准状况下将1.92g铜粉投入一定量浓HNO3中随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混和气体1.12L,则混和气体中NO的体积为( )
| A、112mL |
| B、1008mL |
| C、224mL |
| D、336mL |
考点:氧化还原反应的计算,化学方程式的有关计算
专题:
分析:n(Cu)=
=0.03mol,混合气体的物质的量为
=0.05mol,结合电子守恒及原子守恒计算.
| 1.92g |
| 64g/mol |
| 1.12L |
| 22.4L/mol |
解答:
解:n(Cu)=
=0.03mol,混合气体的物质的量为
=0.05mol,
设n(NO)=xmol,n(NO2)=ymol,则
由电子守恒及原子守恒可知
,解得x=0.005,y=0.045,
v(NO)=0.005×22.4×1000=112mL,
故选A.
| 1.92g |
| 64g/mol |
| 1.12L |
| 22.4L/mol |
设n(NO)=xmol,n(NO2)=ymol,则
由电子守恒及原子守恒可知
|
v(NO)=0.005×22.4×1000=112mL,
故选A.
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
在铁的氧化物和氧化铝组成的混合物中,加入2mol/L硫酸溶液65mL,恰好完全反应.所得溶液中Fe2+能被标准状况下112mL氯气氧化.则原混合物中金属元素和氧元素的原子个数之比为( )
| A、5:7 | B、4:3 |
| C、3:4 | D、9:13 |
下列物质属于天然高分子化合物的是( )
| A、油脂 | B、塑料 |
| C、纤维素 | D、葡萄糖 |
 控制适合的条件,将反应Fe3++Ag?Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度).已知接通后观察到电流计指针向右偏转.下列判断正确的是( )
控制适合的条件,将反应Fe3++Ag?Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度).已知接通后观察到电流计指针向右偏转.下列判断正确的是( )| A、盐桥中的K+移向乙烧杯 |
| B、一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转 |
| C、在外电路中,电子从石墨电极流向银电极 |
| D、电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 |
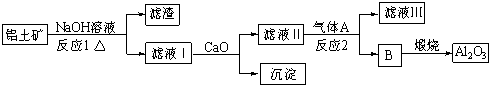
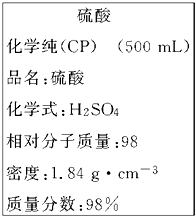 如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol?L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:
如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol?L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有: