题目内容
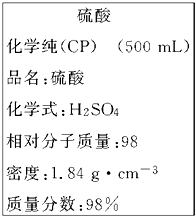 如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol?L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:
如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol?L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.
请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有
(2)经计算,所需浓硫酸的体积约为
(3)对所配制的稀硫酸进行测定,发现其浓度大于1mol?L-1,配制过程中下列各项操作可能引起该误差的原因是
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③用量筒量取浓硫酸后,用蒸馏水将量筒洗涤干净,洗涤液转移到烧杯中
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,再加蒸馏水至刻度线.
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)依据C=
计算浓硫酸的物质的量浓度,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;根据浓硫酸的密度比水大分析;
(3)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=
进行误差分析.
(2)依据C=
| 1000ρω |
| M |
(3)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=
| n |
| V |
解答:
解:(1)配制一定物质的量浓度溶液的一般步骤为:计算、量取、稀释、移液、洗涤、定容、摇匀等操作,所以所需仪器有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管.根据提供的仪器可知,还需仪器是500mL容量瓶,
故答案为:500mL容量瓶;
(2)该浓硫酸的物质的量浓度C=
=18.4mol/L,设需要浓硫酸的体积为V,根据溶液稀释定律C浓V浓=C稀V稀可知:
18.4mol/L×Vml=500mL×1mol?L-1,解得V=27.2mL;
浓硫酸的密度比水大,因此等体积的浓硫酸的质量比水大,根据溶质质量分数公式可知,得到的稀硫酸的溶质质量分数会偏向于浓硫酸的质量分数,即大于49%;
故答案为:27.2;>;
(3)①用量筒量取浓硫酸时,仰视刻度线,导致所取浓硫酸的体积偏大,溶质的物质的量偏大,溶液的浓度偏高,故①正确;
②容量瓶用蒸馏水洗涤后未经干燥,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不变,故②错误;
③用量筒量取浓硫酸后,用蒸馏水将量筒洗涤干净,洗涤液转移到烧杯中,导致所取的浓硫酸的体积偏大,溶质的物质的量偏大,溶液的浓度偏高,故③正确;
④转移溶液时,不慎有少量溶液洒出,导致溶质的物质的量偏小,溶液的浓度偏低,故④错误;
⑤定容时,俯视容量瓶刻度线,导致溶液的体积偏大,溶液的浓度偏低,故⑤错误;
⑥定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,再加蒸馏水至刻度线,导致溶液的体积偏大,溶液的浓度偏低,故⑥错误;
故选:①③⑤.
故答案为:500mL容量瓶;
(2)该浓硫酸的物质的量浓度C=
| 1000×1.84g/ml×98% |
| 98g/mol |
18.4mol/L×Vml=500mL×1mol?L-1,解得V=27.2mL;
浓硫酸的密度比水大,因此等体积的浓硫酸的质量比水大,根据溶质质量分数公式可知,得到的稀硫酸的溶质质量分数会偏向于浓硫酸的质量分数,即大于49%;
故答案为:27.2;>;
(3)①用量筒量取浓硫酸时,仰视刻度线,导致所取浓硫酸的体积偏大,溶质的物质的量偏大,溶液的浓度偏高,故①正确;
②容量瓶用蒸馏水洗涤后未经干燥,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不变,故②错误;
③用量筒量取浓硫酸后,用蒸馏水将量筒洗涤干净,洗涤液转移到烧杯中,导致所取的浓硫酸的体积偏大,溶质的物质的量偏大,溶液的浓度偏高,故③正确;
④转移溶液时,不慎有少量溶液洒出,导致溶质的物质的量偏小,溶液的浓度偏低,故④错误;
⑤定容时,俯视容量瓶刻度线,导致溶液的体积偏大,溶液的浓度偏低,故⑤错误;
⑥定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,再加蒸馏水至刻度线,导致溶液的体积偏大,溶液的浓度偏低,故⑥错误;
故选:①③⑤.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,明确配制原理和过程是解题关键,注意误差分析的方法.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
下列有关实验的叙述正确的是( )
| A、除去水中的Na+、SO42-、Cl-等杂质可用蒸馏的方法 |
| B、除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤 |
| C、用铂丝蘸取少量某溶液进行焰色反应,若火焰呈黄色,则原溶液含有钠盐 |
| D、某溶液加入盐酸酸化的BaCl2溶液,若有白色沉淀生成,则原溶液含有SO42- |
能鉴别MgSO4、A1C13、K2CO3、NH4Cl四瓶溶液的一种试剂是( )
| A、AgNO3溶液 |
| B、盐酸 |
| C、NaOH溶液 |
| D、氨水 |
在标准状况下将1.92g铜粉投入一定量浓HNO3中随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混和气体1.12L,则混和气体中NO的体积为( )
| A、112mL |
| B、1008mL |
| C、224mL |
| D、336mL |
在盛放浓硫酸的试剂瓶的标签上应印有如图警示标记中的( )
A、 |
B、 |
C、 |
D、 |
下列说法正确的是( )
| A、铜与氯气反应时,剧烈燃烧并产生蓝色的烟 |
| B、将金属钠投入硫酸铜溶液中可观察到有红色的铜生成 |
| C、生活中常用的“84”消毒液中的有效成分是NaCl |
| D、次氯酸不如次氯酸盐稳定,故通常用次氯酸盐作为漂白剂和消毒剂的主要成分 |