题目内容
18.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有CC双键的数目为3NA | |
| C. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
分析 A、次氯酸根为弱酸根,在溶液中会水解;
B、苯不是单双键交替的结构;
C、氮气和CO的摩尔质量均为28g/mol;
D、求出二氧化氮的物质的量,然后根据3mol二氧化氮和水反应转移2mol电子来分析.
解答 解:A、次氯酸根为弱酸根,在溶液中会水解,导致个数减少,故溶液中的次氯酸根的个数小于NA个,故A错误;
B、苯不是单双键交替的结构,故苯中无碳碳双键,故B错误;
C、氮气和CO的摩尔质量均为28g/mol,故14g混合物的物质的量为0.5mol,故而两者均为双原子分子,故0.5mol混合物中含NA个原子,故C正确;
D、标况下6.72L二氧化氮的物质的量为0.3mol,而3mol二氧化氮和水反应转移2mol电子,故0.3mol二氧化氮和水反应转移0.2mol电子即0.2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列离子方程式书写正确的是( )
| A. | 铜和稀硝酸反应 Cu+4H++NO3-=Cu2++2H2O+NO↑ | |
| B. | 碳酸氢钠和过量的澄清石灰水反应 2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+CO32- | |
| C. | Fe投入盐酸中 2Fe+6H+=2Fe3++3H2↑ | |
| D. | 氢氧化铝溶于氢氧化钠溶液 Al(OH)3+OH-=AlO2-+2H2O |
13.以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性.
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3.用离子方程式解释现象Ⅰ:2Ag++SO32-=Ag2SO3↓.
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-.
已知:Cu+$\stackrel{稀硫酸}{→}$Cu+Cu2+,Cu2+$\stackrel{I-}{→}$CuI↓(白色)+I2.
①用稀硫酸证实沉淀中含有Cu+的实验现象是析出红色固体.
②通过下列实验证实,沉淀中含有Cu2+和SO32-.

a.白色沉淀A是BaSO4,试剂1是HCl和BaCl2溶液.
b.证实沉淀中含有Cu+和SO32-的理由是棕黄色沉淀与KI溶液反应生成白色沉淀(CuI),证明含有Cu2+,白色沉淀A为硫酸钡,证明含有SO32-.
| 实验 | 试剂 | 现象 | |
| 滴管 | 试管 | ||
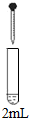 | 0.2mol/L Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ产生白色沉淀 |
| 0.2mol/LCuSO4溶液 | Ⅱ溶液变绿,继续滴加产生棕黄色沉淀 | ||
| 0.1mol/LAl2(SO4)3溶液 | Ⅲ开始无明显变化,继续滴加产生白色沉淀 | ||
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-.
已知:Cu+$\stackrel{稀硫酸}{→}$Cu+Cu2+,Cu2+$\stackrel{I-}{→}$CuI↓(白色)+I2.
①用稀硫酸证实沉淀中含有Cu+的实验现象是析出红色固体.
②通过下列实验证实,沉淀中含有Cu2+和SO32-.

a.白色沉淀A是BaSO4,试剂1是HCl和BaCl2溶液.
b.证实沉淀中含有Cu+和SO32-的理由是棕黄色沉淀与KI溶液反应生成白色沉淀(CuI),证明含有Cu2+,白色沉淀A为硫酸钡,证明含有SO32-.
3.下列反应一定属于氧化反应的是( )
| A. | 失电子的反应 | B. | 原电池的正极反应 | ||
| C. | 放热反应 | D. | 电镀池镀件一极的反应 |
10.下列各项对△H的比较正确的是( )
| A. | 2K(s)+2H2O(1)═2KOH(aq)+H2(g)△H1,2Na(s)+2H2O(1)═2NaOH(aq)+H2(g)△H2,则△H1>△H2 | |
| B. | Mg(s)+2HCl(aq)═MgCl2(aq)+H2(g)△H1,Ca(s)+2HCl(aq)═CaCl2(aq)+H2(g)△H2,则△H1>△H2 | |
| C. | H2(g)+Cl2(g)═2HCl(g),H2(g)+Br2(g)═2HBr(g)△H2,则△H1>△H2 | |
| D. | 2Fe(s)+3Br2(g)═2FeBr3(s)△H1,2Fe(s)+3Cl2(g)═2FeCl3(s)△H2,则△H1<△H2 |
7.下列叙述正确的是( )
| A. | 温度不变,向NH3•H2O溶液中加入NH4Cl,平衡左移,电离平衡常数减小 | |
| B. | pH=12的NH3•H2O溶液加水稀释10倍后,其pH=11 | |
| C. | 向氯化银的浊液中加入少量氯化钠,则氯化银的溶解程度减小 | |
| D. | 在0.1mol•L-1 Na2S溶液中,有c(Na+)+C(H+)=c(S2-)+C(OH-)+C(HS-) |