题目内容
19.有甲乙两个容积均为1L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g)?xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;
②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%.
试回答:(1)甲平衡时A的体积分数为40%;
(2)若乙W%=40%,且建立平衡的过程中乙压强有变化,则x=2,乙中建立平衡时压强的变化为递增(填“递增”或“递减”).
分析 (1)根据恒温恒容,体积之比等于物质的量之比,再利用三段式进行计算;
(2)若乙中W%=40%,说明在恒温恒容条件下,①和②为等效平衡,建立平衡的过程中乙压强有变化,则按化学计量数转化到左边,满足n(A)=4mol、n(B)=2mol,据此计算x.
解答 解:(1)设达平衡时B转化了nmol
2A(g)+B(g)?xC(g),
开始(mol) 4 2 0
转化(mol) 2n n xn
平衡(mol)4-2n 2-n xn
因为C的体积分数为40%,则有$\frac{xn}{4-2n+2-n+xn}$×100%=40%,解得xn=4-2n
所以A的体积分数为=$\frac{4-2n}{4-2n+2-n+xn}$×100%=40%
故答案:40%;
(2)若乙中W%=40%,说明在恒温恒容条件下,①和②为等效平衡,建立平衡的过程中乙压强有变化,则按化学计量数转化到左边,满足n(A)=4mol、n(B)=2mol,故1mol+$\frac{2×3mol}{x}$=4,解得x=2,带入(1)则平衡时A为2mol,B为1mol,C为2mol,所以乙中平衡向逆反应进行,故压强增大;
故答案为:2;递增.
点评 本题考查了化学平衡的计算、等效平衡等,难度中等,注意等效平衡的判断及其应用,有利于提高学生灵活运用基础知识解决实际问题的能力及化学计算能力.

练习册系列答案
相关题目
20.下列物质属于天然纤维的是( )
| A. | 粘胶纤维 | B. | 涤纶 | C. | 丙纶 | D. | 木材 |
10.化工生产中常用 FeS 作沉淀剂除去工业废水中的 Cu2+:Cu2+(aq)+FeS(s)?CuS(s)+Fe2+(aq),下列有关叙述中正确的是( )
| A. | FeS的Ksp小于CuS的Ksp | |
| B. | 达到平衡时c(Fe2+)=c(Cu2+) | |
| C. | 溶液中加入少量 Na2S固体后,溶液中c (Cu2+)、c (Fe2+)都减小 | |
| D. | 该反应平衡常数 K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ |
4.氯碱厂质检人员用滴定法测定某NaOH溶液的浓度.
(1)洗涤滴定管前必须首先检漏.
(2)选用盐酸作为标准溶液进行测定实验.将盐酸装入滴定管,NaOH溶液装入锥形瓶,滴加甲基橙/酚酞作指示剂.滴定时,眼睛注视锥形瓶中溶液颜色的变化,当锥形瓶内溶液由黄色变橙色/红色变无色、且在半分钟内不褪去即达滴定终点.记录此时滴定管内液面读数V(末).
(3)实验数据记录及处理:
标准盐酸浓度:0.1054mol/L
若NaOH溶液的准确浓度为 0.1005mol/L,实验误差是5.4%.
(4)若测定结果偏低,原因可能是ACD.
A、见到指示剂的颜色有变化就停止滴定
B、锥形瓶用蒸馏水清洗后,未用待装液润洗
C、读数时,若滴定前视线偏低,滴定后视线偏高
D、滴定前滴定管的尖嘴部分充满液体,滴定终点时尖嘴部分有气泡.
(1)洗涤滴定管前必须首先检漏.
(2)选用盐酸作为标准溶液进行测定实验.将盐酸装入滴定管,NaOH溶液装入锥形瓶,滴加甲基橙/酚酞作指示剂.滴定时,眼睛注视锥形瓶中溶液颜色的变化,当锥形瓶内溶液由黄色变橙色/红色变无色、且在半分钟内不褪去即达滴定终点.记录此时滴定管内液面读数V(末).
(3)实验数据记录及处理:
标准盐酸浓度:0.1054mol/L
| 实验次数 | 待测氢氧化钠溶液体积(mL) | 标准盐酸体积(mL) | NaOH溶液浓度(mol/L) | ||
| 初读数 | 末读数 | 体积 | |||
| 1 | 20.00 | 0.50 | 20.70 | 20.20 | 0.1059 |
| 2 | 20.00 | 6.00 | 26.00 | 20.00 | |
(4)若测定结果偏低,原因可能是ACD.
A、见到指示剂的颜色有变化就停止滴定
B、锥形瓶用蒸馏水清洗后,未用待装液润洗
C、读数时,若滴定前视线偏低,滴定后视线偏高
D、滴定前滴定管的尖嘴部分充满液体,滴定终点时尖嘴部分有气泡.
8.在恒温、恒容的条件下,有反应2A(g)+2B(g)?C(g)+3D(g),现从两条途径分别建立平衡.途径Ⅰ:A、B的起始浓度均为2mol•L-1,C、D的起始浓度为0;途径Ⅱ:C、D的起始浓度为2mol•L-1和6mol•L-1,A、B的起始浓度为0.则以下叙述正确的是( )
| A. | 两途径最终达到平衡时,体系内混合气体的百分组成相同 | |
| B. | 两途径最终达到平衡时,体系内混合气体的百分组成不同 | |
| C. | 途径Ⅰ到达平衡所用时间一定等于途径Ⅱ到达平衡所用时间 | |
| D. | 达平衡时,途径Ⅰ所得混合气体的密度等于途径Ⅱ所得混合气密度的一半 |
9.已知室温时,0.1mol•L-1某一元酸HA在水中有0.01%发生电离,下列叙述正确的是( )
| A. | 该溶液的PH=4 | |
| B. | 升高温度,溶液的PH增大 | |
| C. | 稀释时溶液中所有离子的浓度都减少 | |
| D. | 此酸的电离平衡常数约为1×10-9 |
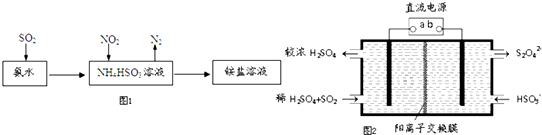 SO2和NOx都是大气污染物.
SO2和NOx都是大气污染物.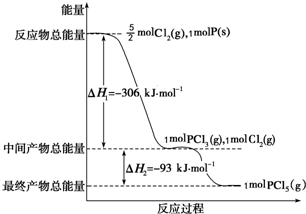 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).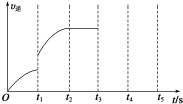 一定温度下在体积为5L的密闭容器中发生可逆反应.
一定温度下在体积为5L的密闭容器中发生可逆反应.