题目内容
4.在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应H2(g)+I2(g)?2HI(g)△H<0.改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)(1)升高温度增大;
(2)充入更多的H2增大;
(3)扩大容器的体积减小;
(4)容器容积不变,通入氖气不变.
分析 增大浓度、增大压强、使用催化剂,反应速率加快,扩大体积,压强减小,速率减小,恒容容器中加入惰气反应速率不变,以此解答该题.
解答 解:(1)升高温度,反应速率增大,故答案为:增大;
(2)再充入H2,反应物浓度增大,化学反应速率增大,故答案为:增大;
(3)将容器容积扩大,相当于减小压强,则反应速率减小,故答案为:减小;
(4)容器容积不变,通入氖气,反应体系中各物质的浓度不变,则反应速率不变,故答案为:不变.
点评 本题考查影响化学反应速率的因素,为高频考点,侧重于学生的分析能力的考查,题目较简单,明确常见的影响因素即可解答.

练习册系列答案
相关题目
12.下列分子或离子中,立体构型不是平面三角形的是( )
| A. | CO32- | B. | CH4 | C. | BF3 | D. | SO3 |
16.下列说法正确的是( )
| A. | 金属和非金属化合形成离子键,非金属之间只形成共价键 | |
| B. | 根据电离方程式:HCl﹦H++Cl-,可判断HCl分子里存在离子键 | |
| C. | 干冰气化时破坏分子中的共价键 | |
| D. | 有机化合物分子中的碳原子不仅以共价键形成碳链,也能形成碳环 |
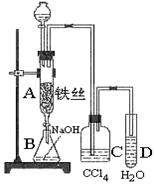 某化学课外小组用图装置使苯与液溴反应.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用图装置使苯与液溴反应.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
 ②N2
②N2 .
.