题目内容
 X、Y、Z、W四种短周期元素在周期表中的位置如图所示.已知这四种元素原子的核电荷数之和为36.则这四种元素按X、Y、Z、W顺序依次是( )
X、Y、Z、W四种短周期元素在周期表中的位置如图所示.已知这四种元素原子的核电荷数之和为36.则这四种元素按X、Y、Z、W顺序依次是( )| A、N、P、O、C |
| B、C、N、O、P |
| C、O、S、N、F |
| D、C、Si、Al、N |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由X、Y、Z、W四种短周期元素在周期表中的位置,可知W、X、Z处于第二周期,Y处于第三周期,设X的原子序数为a,由图可知,Y的原子序数为a+8,W的原子序数为a-1,Z的原子序数为a+1,结合四元素核电荷数之和列方程计算解答.
解答:
解:由X、Y、Z、W四种短周期元素在周期表中的位置,可知W、X、Z处于第二周期,Y处于第三周期,设X的原子序数为a,由图可知,Y的原子序数为a+8,W的原子序数为a-1,Z的原子序数为a+1,四种元素原子的核电荷数之和为36,则a-1+a+a+1+a+8=36,解得a=7,故X为N元素、Y为P元素、Z为O元素、W为C元素,
故选A.
故选A.
点评:本题考查位置结构性质的关系,难度不大,注意理解同主族元素原子序数关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
交警执法查处酒驾时,主要测量驾驶员体内的( )
| A、醋酸 | B、乙醇 | C、甲醛 | D、葡萄糖 |
下列说法正确的是( )
| A、易溶于水的物质一定是电解质 |
| B、与酸反应生成盐和水的物质一定是碱 |
| C、氧化还原反应中的某一物质不可能同时既被氧化又被还原 |
| D、丁达尔效应是区别胶体和溶液的一种常用物理方法 |
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)═MgO(s)+CO2(g)+SO2(g)△H>0.该反应在恒容的密闭容器中进行,下列说法正确的是( )
| A、平衡后保持其他条件不变,分离出部分MgO,平衡后向正反应方向移动 |
| B、平衡后保持其他条件不变,升高温度CO的转化率及该反应的化学平衡常数都变大 |
| C、当生产速率v(CO2):v(SO2)=1:1时反应会达到平衡 |
| D、平衡后保持其他条件不变,通入CO再次平衡时CO与CO2的物质的量之比减小 |
只需用一种试剂即可将酒精、四氯化碳、己烯、甲苯四种无色液体区分开来,该试剂是( )
| A、FeCl3溶液 |
| B、溴水 |
| C、稀盐酸 |
| D、金属钠 |
下列反应的离子方程式正确的是( )
| A、氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
| B、在含有Mn2+的溶液中加入稀硫酸酸化,再加入PbO2,反应体系显紫红色5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O |
| C、碳酸氢铵和足量的氢氧化钠溶液反应:NH4++OH-═NH3↑+H2O |
| D、硫化钠水溶液呈碱性的原因:S2-+2H2O?H2S↑+2OH- |
在体积为100ml的密闭容器中,放入反应物A和B,在不同的温度下发生反应:2A(s)+B(g)?2C(g),得到该反应平衡常数与温度的关系如表所示.
下列说法正确的是( )
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A、加热平衡向右移动 |
| B、25℃时反应2C?2A(s)+B(g)的平衡常数为0.5 |
| C、在80℃时,测得某时刻,B、C浓度均为0.5mol/L,则此时v(正)>v(逆) |
| D、80℃达到平衡时,再投入一定量的A,平衡正向移动 |
下列物质中,是强电解质的是( )
| A、二氧化碳气体 | B、固体氯化钠 |
| C、蔗糖溶液 | D、盐酸 |
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
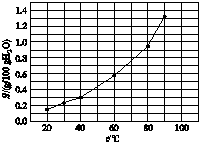

| A、60℃时溴酸银的Ksp约等于6×10-4 |
| B、温度升高时溴酸银溶解速度加快 |
| C、溴酸银的溶解时放热过程 |
| D、若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |