题目内容
11.下列各组混合物中能够使用分液漏斗分离的是( )| A. | 乙醇和水 | B. | 苯和水 | C. | 乙酸和乙酸乙酯 | D. | 汽油和煤油 |
分析 能用分液漏斗分离的物质应互不相溶,以此解答.
解答 解:题中水和乙醇、乙酸和乙酸乙酯以及汽油和煤油互溶,不能用分液的方法分离,应用蒸馏的方法,而苯和水互不相溶,可用分液的方法分离.
故选B.
点评 本题考查物质的分离、提纯,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握物质的性质的异同,把握常见分离方法和实验的注意事项,难度不大.

练习册系列答案
相关题目
2.有一瓶澄清溶液,其中可能含有可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-.取该溶液进行以下实验:
(1)填写表中开空白:
(2)根据以上事实,该溶液中肯定存在的离子是Ba2+、I-、NH4+.
(1)填写表中开空白:
| 实验步骤 | 肯定不存在的离子 |
| ①用PH试纸检验,溶液呈强酸性 | |
| ②取出部分溶液,加入少量CCl4和数滴新制氯水,振荡,精置CCl4层呈紫红色 | |
| ③另取出部分溶液,向其加入NaOH溶液,使溶液从酸性变为碱性,在滴加过程中及滴加完毕后,均无沉淀产生 | |
| ④取③中的部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝 | |
| ⑤另取③中的部分碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成 |
6.下列离子方程式书写正确的是( )
| A. | 碳酸钙中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| B. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 碳酸钠溶液中加入氢氧化铜:Cu2++CO32-═CuCO3↓ | |
| D. | 澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
16.某混合溶液中溶质所含离子的物质的量浓度如表,则下列有关说法不正确的是( )
| 溶质所含离子 | SO42- | M | Mg2+ | Fe2+ |
| 物质的量浓度 | c | 3 | 3 | 2 |
| A. | 若M是NO3-,则c为3.5 | |
| B. | 若使Fe2+浓度降低,可以加入试剂NaOH | |
| C. | 若M是NH4+,则配制溶液所用的溶质不一定是3种 | |
| D. | 若加入BaCl2溶液能产生两种沉淀,则M可能是CO32- |
3.下列分子式表示的物质一定是纯净物的是( )
| A. | C2H6O | B. | C2H4Cl2 | C. | CH4O | D. | C |
10.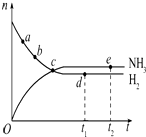 合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,773 K下反应至t1时刻,n(H2)比图中d点的值大 |