题目内容
4.足量锌与浓H2SO4充分在加热下反应生成会SO2和H2的混合气体;锌和稀硫酸反应只有H2生成.现有甲乙两研究小组分别实验探究:(1)甲研究小组按图1实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL18.5mol•L-1的浓硫酸,经过一段时间反应,Zn完全溶解

①填写仪器名称:a分液漏斗、b圆底烧瓶
②写出装置A中生成能使品红溶液褪色的化学反应方程式:Zn+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+2H2O+SO2↑.
③装置D中加入的试剂是浓硫酸.
④U型管G的作用为防止空气中的水蒸气进入干燥管影响杂质气体的检验,干扰实验.
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为防止倒吸.
⑥证明反应生成SO2和H2的实验现象是B中品红褪色,E中有红色物质生成且F中的无水硫酸铜变蓝.
⑦若A中生成标准状况下的气体33.6L,将A反应后的溶液稀释到1L,测得溶液中H+的浓度为0.1mol•L-1,则稀释液中SO42-的物质的量浓度是1.55 mol•L-1.
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行图2所示实验,分析影响反应速率的因素.
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如表所示:
| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+),c(H+)的影响是主要因素.
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是:断开K时,反应的化学能主要转化成热能;闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高是主要影响因素,故反应速率更快.
分析 (1)A是制取气体的装置,制备的气体中有二氧化硫、氢气、水蒸汽,B装置是除去二氧化硫,可以用氢氧化钠等碱液吸收;C装置是检验二氧化硫是否除尽,D装置是浓硫酸,吸水干燥作用;E装置是用还原性气体还原氧化铜,F装置无水硫酸铜,检验是否有水生成;G是防止空气中H2O进入干燥管而影响杂质气体的检验,
①结合仪器图形和作用得到名称;
②装置A中生成能使品红溶液褪色的气体为二氧化硫,是锌和浓硫酸反应得到硫酸锌、二氧化硫和水;
③是对气体进行干燥的试剂为浓硫酸;
④G是防止空气中H2O进入干燥管而影响杂质气体的检验;
⑤A、B间应增加图中的甲装置是安全瓶;
⑥B装置是检验二氧化硫,B中品红褪色,证明反应生成SO2;E装置是用还原性气体还原氧化铜,F装置无水硫酸铜,检验是否有水生成;
⑦反应后的溶液稀释到1L,测得氢离子浓度为0.1mol/L,稀释后硫酸的浓度为0.05mol/L,反应剩余的硫酸为0.05mol×1L=0.05mol,则反应后溶液中硫酸的物质的量浓度为$\frac{0.05mol×1L}{0.1L}$=0.5mol/L,为稀硫酸,故发生反应:Zn+2H2SO4=ZnSO4+SO2↑+H2O、Zn+H2SO4=ZnSO4+H2↑,生成的气体为SO2、H2混合气体,
令混合气体中SO2、H2的物质的量分别为xmol、ymol,根据二者体积与消耗硫酸的物质的量列方程,据此计算解答;
(2)②根据氢离子浓度大小与速率的关系分析;
③断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,根据温度对速率的影响分析.
解答 解:(1)①装置图中仪器a为分液漏斗,b为圆底烧瓶,
故答案为:分液漏斗;圆底烧瓶;
②装置A中生成能使品红溶液褪色的气体为二氧化硫,是锌和浓硫酸反应得到硫酸锌、二氧化硫和水,反应的化学方程式为:Zn+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+2H2O+SO2↑,
故答案为:Zn+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+2H2O+SO2↑;
③D装置是浓硫酸,吸水干燥作用,
故答案为:浓硫酸;
④G装置中的碱石灰是防止空气中H2O进入干燥管而影响杂质气体的检验,干扰实验,
故答案为:防止空气中的水蒸气进入干燥管影响杂质气体的检验,干扰实验;
⑤A、B间应增加图中的甲装置,是为了防止B装置中的液体倒吸,
故答案为:防止倒吸;
⑥B装置是检验二氧化硫,B中品红褪色,证明反应生成SO2;E装置是用还原性气体还原氧化铜,F装置无水硫酸铜,检验是否有水生成,只要黑色变红色,无水硫酸铜变蓝色,证明反应生成氢气;
故答案为:B中品红褪色,E中有红色物质生成且F中的无水硫酸铜变蓝;
⑦反应后的溶液稀释到1L,氢离子浓度为0.1mol/L,稀释后硫酸的浓度为0.05mol/L,则反应后溶液中硫酸的物质的量浓度为$\frac{0.05mol×1L}{0.1L}$=0.5mol/L,为稀硫酸,故发生反应:Zn+2H2SO4=ZnSO4+SO2↑+H2O、Zn+H2SO4=ZnSO4+H2↑,生成的气体为SO2、H2混合气体,物质的量为=$\frac{33.6L}{22.4L/mol}$=1.5mol,
参加反应的n(H2SO4)=0.1L×18.5mol/L-0.05mol×1L=1.8mol,
令混合气体中SO2、H2的物质的量分别为xmol、ymol,则:
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2x x
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
x+y=1.5
2x+y=1.8
解之得 x=0.3,y=1.2
根据原子守恒反应后溶液中SO42- 为n浓硫酸-n(SO2)=0.1L×18.5mol/L-0.3mol=1.55mol,
故答案为:1.55;
(2)②由于反应前期形成原电池反应速率快,氢离子消耗的多,则在后期,闭合K时溶液中氢离子浓度小,氢离子浓度越小反应速率越小,断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+),所以在反应后期,断开K时的反应速率快于闭合K时的反应速率;
故答案为:断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+),c(H+)的影响是主要因素;
③断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,则随着反应进行,断开K时,放出的热量使溶液的温度升高,温度越高反应速率越快;
故答案为:断开K时,反应的化学能主要转化成热能;闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高是主要影响因素,故反应速率更快.
点评 本题是实验探究题、原电池原理的应用、影响速率的因素等,既有气体的制取又有气体的除杂和气体的吸收,还有气体的检验,综合性比较强,注意实验原理的掌握,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 选项 | 实验操作与现象 | 结论 |
| A | 用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色 | 溶液中含有Na+ |
| B | 向浓度均为0.1mol•L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀. | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
| C | 室温下,用pH试纸测得:0.1mol•L-1Na2CO3溶液的pH约为11;0.1mol•L-1NaHCO3溶液的pH约为8. | HCO3-结合H+的能力比CO32-的强 |
| D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗的干净 | 存在可逆过程:Fe3++Ag?Fe2++Ag+,且溶解度AgCl<Ag2SO4 |
| A. | A | B. | B | C. | C | D. | D |
①取代反应 ②加成反应 ③水解反应 ④酯化反应 ⑤加聚反应.
| A. | ①② | B. | ③⑤ | C. | ②⑤ | D. | ①④ |

| A. | 它有酸性,不能与NaHCO3溶液反应 | B. | 不能使溴水褪色 | ||
| C. | 1molA最多能和7mol NaOH反应 | D. | 1molA最多能和6mol H2反应 |

| A. | 该反应是放热反应 | B. | 升高温度平衡向逆反应方向移动 | ||
| C. | 增大压强,平衡不发生移动 | D. | 升高温度,反应的平衡常数K增大 |
| A. | 标准状况下,22.4L苯含有约NA个C6H6分子 | |
| B. | 1mol Na与足量乙醇完全反应,失去2NA电子 | |
| C. | 1 mol苯分子中含有C═C双键数为3NA | |
| D. | 常温常压下,8gCH4含有5NA个电子 |
| A. | Li | B. | P | C. | He | D. | F |
| A. | 水的离子积变大,c(H+)变大,呈酸性 | B. | 水的离子积不变,c(H+)不变,呈中性 | ||
| C. | 水的离子积变小,c(H+)变小,呈碱性 | D. | 水的离子积变大,c(H+)变大,呈中性 |
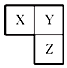 X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y原子的最外层 电子数是次外层电子数的3倍,下列说法正确的是( )
X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y原子的最外层 电子数是次外层电子数的3倍,下列说法正确的是( )| A. | 在三种元素形成的简单气态氢化物中,Y的气态氢化物沸点最高 | |
| B. | Z元素的氧化物对应的水化物一定是一种强酸 | |
| C. | 三种元素原子半径的大小顺序为:X>Y>Z | |
| D. | Z的单质与Fe反应生成的化合物中,铁元素显+3价 |