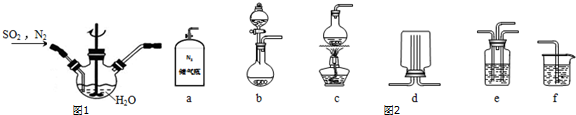
题目内容
12.下列关系的表述中正确的是( )| A. | 向NaHSO3溶液中通入NH3至中性,溶液中存在:c(NH4+)>c(SO32-) | |
| B. | NH4Cl和NH3•H2O混合液pH=7,一定存在c(NH4+)=c(Cl-) | |
| C. | NaHCO3溶液中存在HCO3-+H2O?H3O++CO32-,加水稀释后c(H+)减小 | |
| D. | pH相同的氯化铵与硫酸亚铁铵两种溶液中铵根离子浓度前者大 |
分析 A.向NaHSO3溶液中通入NH3至中性,c(H+)=c(OH-),溶质为Na2SO3和(NH4)2SO3;
B.NH4Cl和NH3•H2O混合液pH=7,温度不知溶液不一定为中性,依据电荷守恒分析判断;
C.NaHCO3溶液中存在电离平衡,HCO3-+H2O?H3O++CO32-,碳酸氢钠溶液中碳酸氢根离子水解溶液显碱性,加水稀释促进水解,溶液中氢氧根离子浓度减小,结合离子积常数判断;
D.硫酸亚铁铵溶液中亚铁离子水解抑制铵根离子水解.
解答 解:A.向NaHSO3溶液中通入NH3至中性,c(H+)=c(OH-),溶液中溶质为Na2SO3和(NH4)2SO3,c(NH4+)<c(SO32-),故A错误;
B.NH4Cl和NH3•H2O混合液,电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),pH=7溶液不一定呈中性,所以不一定存在c(NH4+)=c(Cl-),故B错误;
C.NaHCO3溶液中存在电离平衡,HCO3-+H2O?H3O++CO32-,碳酸氢钠溶液中碳酸氢根离子水解溶液显碱性,加水稀释促进水解,溶液中氢氧根离子浓度减小,结合离子积常数判断溶液中氢离子浓度增大,故C错误;
D.pH相同的氯化铵与硫酸亚铁铵两种溶液中,硫酸亚铁铵溶液中亚铁离子水解抑制铵根离子水解,所以铵根离子浓度前者大,故D正确;
故选D.
点评 本题考查了盐类水解原理分析、电解质溶液中离子浓度大小比较、溶液中电荷守恒、注意溶液PH=7不一定是中性溶液,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.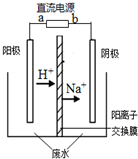 最近有研究人员利用隔膜电解法处理高浓度的乙醛废水.乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法不正确的是( )
最近有研究人员利用隔膜电解法处理高浓度的乙醛废水.乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法不正确的是( )
 最近有研究人员利用隔膜电解法处理高浓度的乙醛废水.乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法不正确的是( )
最近有研究人员利用隔膜电解法处理高浓度的乙醛废水.乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法不正确的是( )| A. | 电解过程中,阳极附近的乙醛被氧化 | |
| B. | 阳极反应CH3CHO-2e-+H2O═CH3COOH+2H+ | |
| C. | 若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入CH4 | |
| D. | 现处理含1mol乙醛的废水,至少需转移2mol电子 |
7.下列说法不正确的是( )
| A. | 高纯度二氧化硅广泛用于制作光导纤维,其遇强碱会“断路” | |
| B. | 家用“84”消毒液可用来漂白衣物,为了增强漂白效果,可加入浓盐酸 | |
| C. | 浸泡过高锰酸钾溶液的硅藻土可以吸收乙烯,所以可用来保鲜水果 | |
| D. | 加热能杀死甲型 H1N1流感病毒是因为蛋白质受热变性 |
4.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 22.4LO3中含3NA个氧原子 | |
| B. | 标准状况下,22.4LCH2Cl2含有2NA氯原子 | |
| C. | 1molSO2与足量的H2S充分反应,转移NA个电子 | |
| D. | 16gCH4中含有10NA个质子 |
17.下列实验中,对应的操作,现象以及结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将铜粉加入到浓硫酸中 | 无明显现象 | 铜被浓硫酸钝化 |
| B | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末 | 产生红褐色沉淀 | 除去MgCl2溶液中的Fe3+ |
| C | 将混有乙酸的乙酸乙酯加入到分液漏斗中,加入氢氧化钠溶液,振荡,静置,分液 | 溶液分层 | 除去乙酸乙酯中的乙酸 |
| D | 分别向两只试管中加入同浓度,同体积的草酸溶液,再分别加入同体积、不同浓度的酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色时间不同 | 浓度不同反应速率不同 |
| A. | A | B. | B | C. | C | D. | D |
18.下列说法不正确的是( )
| A. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米离子的聚集都是化学变化 | |
| B. | 有一种新发现的固体碳单质,称为“纳米泡沫”,外形似海绵,密度小有磁性,这种碳与金刚石的关系是同素异形体 | |
| C. | 植物秸秆发酵制沼气、玉米制乙醇、城市与工业有机废弃物的再利用都涉及生物质能 | |
| D. | 有科学家称硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用 |
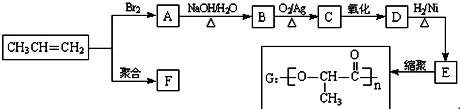
 +2H2O.
+2H2O. .
.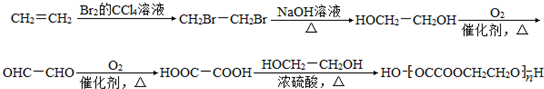 .
.