题目内容
已知,在450℃并有催化剂存在下进行如下反应:
2SO2(g)+O2(g)?2SO3(g)△H=-190kJ?mol-1
(1)硫酸工业中该反应在接触室里进行,需要通入过量空气的目的是 ;该反应不在更高温度下进行的原因是 .
(2)在容积固定的密闭容器中,下列情况已达到平衡状态的是 .
A.v(O2)正=2v(SO3)逆 B.容器中气体的压强不随时间而变化
C.容器中气体的密度不随时间而变化 D.容器中气体的原子总数不随时间而变化
(3)当向上述平衡体系中通入18O2气体,再次达到平衡时,18O存在于 中.
A. SO2、O2 B.SO2、SO3 C.SO3 D.SO2、SO3、O2
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,在450℃并有催化剂条件下,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)= mol( L?min-1);放出的热量为 kJ;该温度下的平衡常数为 ;若继续通入0.20mol SO2和0.10mol O2,则再次平衡时,二氧化硫的转化率 (选填“变大”或“变小”或“不变”).
2SO2(g)+O2(g)?2SO3(g)△H=-190kJ?mol-1
(1)硫酸工业中该反应在接触室里进行,需要通入过量空气的目的是
(2)在容积固定的密闭容器中,下列情况已达到平衡状态的是
A.v(O2)正=2v(SO3)逆 B.容器中气体的压强不随时间而变化
C.容器中气体的密度不随时间而变化 D.容器中气体的原子总数不随时间而变化
(3)当向上述平衡体系中通入18O2气体,再次达到平衡时,18O存在于
A. SO2、O2 B.SO2、SO3 C.SO3 D.SO2、SO3、O2
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,在450℃并有催化剂条件下,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=
考点:化学平衡状态的判断,化学平衡的计算
专题:化学平衡专题
分析:(1)过量的空气来源丰富,成本低且能提高二氧化硫的转化率;该反应是放热反应,升高温度平衡逆向进行,二氧化硫转化率减小,不利于三氧化硫的生成,且影响了催化剂的催化活性;
(2)根据达到平衡状态时的特征:正逆反应速率相等、各组分的浓度、百分含量不再变化进行判断;
(3)可逆反应中的两个化学反应,在相同条件下同时向相反方向进行,两个化学反应构成一个对立的统一体.根据质量守恒定律可知,反应前后的元素守恒,一段时间后的可逆反应体系中,每种物质都会存在18O;
(4)根据化学方程式求出反应的O2的物质的量,利用v=
=
求出氧气的速率;根据热化学方程式及反应消耗的氧气的物质的量计算出放出的热量;根据达到平衡时各组分浓度及平衡常数表达式计算出该温度下的平衡常数;根据影响化学平衡的因素来判断平衡移动方向及二氧化硫的转化率;
(2)根据达到平衡状态时的特征:正逆反应速率相等、各组分的浓度、百分含量不再变化进行判断;
(3)可逆反应中的两个化学反应,在相同条件下同时向相反方向进行,两个化学反应构成一个对立的统一体.根据质量守恒定律可知,反应前后的元素守恒,一段时间后的可逆反应体系中,每种物质都会存在18O;
(4)根据化学方程式求出反应的O2的物质的量,利用v=
| △c |
| △t |
| ||
| △t |
解答:
解:(1)实际生产中要用过量的空气,原因是氧气来源丰富、成本低的反应物浓度,提高SO3产量;该反应为放热反应,温度太高尽管反应速率快,但是平衡逆向移动,二氧化硫的转化率降低,三氧化硫的产量减小,且温度过高,会影响催化剂的催化活性,
故答案为:提高二氧化硫的转化率;该反应为放热反应,温度过高不利于平衡正向移动,且有可能影响催化剂的催化活性;
(2)A.v(O2)正=2v(SO3)逆,表示的是正逆反应,但是不满足氧气和三氧化硫的化学计量数关系,说明正逆反应速率不相等,没有达到平衡状态,故A错误;
B.该反应是气体体积减小的反应,若容器中气体的压强不随时间而变化,说明正逆反应速率相等,达到了平衡状态,故B正确;
C.该反应两边都是气体,气体的质量不变,又容器的容积不变,所以反应过程中密度始终不变,密度不能作为判断平衡状态的依据,故C错误;
D.化学反应中遵循质量守恒定律,容器中气体的原子总数始终不随时间而变化,所以原子总数不变不能作为判断平衡状态的依据,故D错误;
故选B;
(3)可逆反应一定是同一条件下能互相转换的反应,如二氧化硫、氧气在催化剂、加热的条件下,生成三氧化硫;而三氧化硫在同样的条件下可分解为二氧化硫和氧气.故18O2中的18O通过化合反应存在于SO3中,SO3 中的18O通过分解反应会存在于SO2中,最终SO3、SO2、O2中都含有18O,
故选D;
(4)达到平衡时生成0.18molSO3,则:
2SO2 +O2 ?2SO3
反应前(mol) 0.20 0.10 0
变化(mol) 0.18 0.09 0.18
平衡时(mol) 0.02 0.01 0.18
达到平衡时各组分的浓度为:c(SO2)=
=0.004mol/L,c(O2)=
=0.002mol/L,c(SO3)=
=0.036mol/L,
氧气的速率v=
=
=
=0.036mol?L-1?min-1;
达到平衡时消耗了0.09mol氧气,反应放出的热量为:190kJ?mol-1×0.09mol=17.1kJ;
该温度下该反应的平衡常数为:K=
=
≈4.05×104;
继续通入0.30molSO2和0.15molO2,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动,二氧化硫的转化率变大,
故答案为:0.036;17.1;4.05×104;变大.
故答案为:提高二氧化硫的转化率;该反应为放热反应,温度过高不利于平衡正向移动,且有可能影响催化剂的催化活性;
(2)A.v(O2)正=2v(SO3)逆,表示的是正逆反应,但是不满足氧气和三氧化硫的化学计量数关系,说明正逆反应速率不相等,没有达到平衡状态,故A错误;
B.该反应是气体体积减小的反应,若容器中气体的压强不随时间而变化,说明正逆反应速率相等,达到了平衡状态,故B正确;
C.该反应两边都是气体,气体的质量不变,又容器的容积不变,所以反应过程中密度始终不变,密度不能作为判断平衡状态的依据,故C错误;
D.化学反应中遵循质量守恒定律,容器中气体的原子总数始终不随时间而变化,所以原子总数不变不能作为判断平衡状态的依据,故D错误;
故选B;
(3)可逆反应一定是同一条件下能互相转换的反应,如二氧化硫、氧气在催化剂、加热的条件下,生成三氧化硫;而三氧化硫在同样的条件下可分解为二氧化硫和氧气.故18O2中的18O通过化合反应存在于SO3中,SO3 中的18O通过分解反应会存在于SO2中,最终SO3、SO2、O2中都含有18O,
故选D;
(4)达到平衡时生成0.18molSO3,则:
2SO2 +O2 ?2SO3
反应前(mol) 0.20 0.10 0
变化(mol) 0.18 0.09 0.18
平衡时(mol) 0.02 0.01 0.18
达到平衡时各组分的浓度为:c(SO2)=
| 0.02mol |
| 5L |
| 0.01mol |
| 5L |
| 0.18mol |
| 5L |
氧气的速率v=
| △c |
| △t |
| ||
| △t |
| ||
| 0.5min |
达到平衡时消耗了0.09mol氧气,反应放出的热量为:190kJ?mol-1×0.09mol=17.1kJ;
该温度下该反应的平衡常数为:K=
| c2(SO3) |
| c2(SO2)?c(O2) |
| (0.036)2 |
| (0.004)2×(0.002) |
继续通入0.30molSO2和0.15molO2,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动,二氧化硫的转化率变大,
故答案为:0.036;17.1;4.05×104;变大.
点评:本题考查了化学平衡的计算、化学平衡状态的判断、化学反应速率的计算,题目难度中等,注意明确化学平衡状态的判断方法,掌握利用三段式进行化学平衡的计算方法,明确化学平衡常数概念及表达式.

练习册系列答案
相关题目
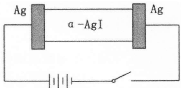 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关说法不正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关说法不正确的是( )| A、若α-AgI是Ag+导电,则通电一段时间后晶体质量不变 |
| B、若α-AgI是Ag+导电,则通电一段时间后晶体质量减少 |
| C、阳极反应为:Ag一e-=Ag+ |
| D、阴极质量不断增加 |
下列溶液中微粒浓度关系一定正确的是( )
| A、氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B、pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
| C、常温下,等物质的量浓度的三种溶液①(NH4)2SO4 ②NH4Cl③(NH4)2Fe(SO4)2中c(NH4+):②<①<③ |
| D、0.1mol?L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
下列物质之间的相互关系错误的是( )
| A、CH3-CH2-NO2和N2H-CH2-COOH互为同分异构体 |
| B、O2和O3互为同素异形体 |
| C、CH3CH3和CH3CH3CH互为同系物 |
| D、干冰和冰为同一种物质 |



 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X+离子核外有10个电子;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X+离子核外有10个电子;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.


