��Ŀ����
I���״���һ������ȼ�ϣ�������ȼ�ϵ�أ���ҵ�Ͽ����������ַ�Ӧ�Ʊ��״���
CO��g��+2H2��g��?CH3OH��g����H1
CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H2
��֪��2H2��g��+O2��g��=2H2O��g����H3����2CO��g��+O2��g��=2CO2��g�� �ķ�Ӧ�ȡ�H= ���á�H1����H2����H3��ʾ����
II����ҵ�Ͽ����á���������ת������������������ӦΪ��CH4��g��+H2O��g��?CO��g��+3H2��g����
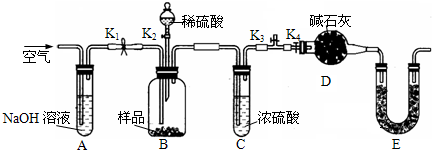
��֪�¶ȡ�ѹǿ��ˮ̼��[
]�Լ���ƽ�⺬����Ӱ����ͼ1��
��1���¶ȶԸ÷�Ӧ�ķ�Ӧ���ʺ�ƽ���ƶ���Ӱ���� ��
��2�������������䣬����ͼ2�л���ѹǿΪ2MPaʱ��CH4ƽ�⺬����ˮ̼��֮���ϵ���ߣ�
��ֻҪ�����µı仯���ߣ�
��3����֪����700�棬1MPaʱ��1mol CH4��1mol H2O��1L���ܱ������з�Ӧ��6���Ӵﵽƽ�⣬��ʱCH4��ת����Ϊ80%������6����H2��ƽ����Ӧ���ʺ��¶��·�Ӧ��ƽ�ⳣ���Ƕ��٣���д��������̣��������С�����һλ���֣���
III��ijʵ��С�������ͼ3��ʾ�ĵ��װ�ã������ĵ缫��ӦʽΪ ��
CO��g��+2H2��g��?CH3OH��g����H1
CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H2
��֪��2H2��g��+O2��g��=2H2O��g����H3����2CO��g��+O2��g��=2CO2��g�� �ķ�Ӧ�ȡ�H=
II����ҵ�Ͽ����á���������ת������������������ӦΪ��CH4��g��+H2O��g��?CO��g��+3H2��g����
��֪�¶ȡ�ѹǿ��ˮ̼��[
| n(H2O) |
| n(CH4) |
��1���¶ȶԸ÷�Ӧ�ķ�Ӧ���ʺ�ƽ���ƶ���Ӱ����
��2�������������䣬����ͼ2�л���ѹǿΪ2MPaʱ��CH4ƽ�⺬����ˮ̼��֮���ϵ���ߣ�
��ֻҪ�����µı仯���ߣ�
��3����֪����700�棬1MPaʱ��1mol CH4��1mol H2O��1L���ܱ������з�Ӧ��6���Ӵﵽƽ�⣬��ʱCH4��ת����Ϊ80%������6����H2��ƽ����Ӧ���ʺ��¶��·�Ӧ��ƽ�ⳣ���Ƕ��٣���д��������̣��������С�����һλ���֣���
III��ijʵ��С�������ͼ3��ʾ�ĵ��װ�ã������ĵ缫��ӦʽΪ

���㣺����ٷֺ������¶ȡ�ѹǿ�仯����,�ø�˹���ɽ����йط�Ӧ�ȵļ���,��ѧ��Դ���͵��,�û�ѧƽ�ⳣ�����м���
ר�⣺
���������ݸ�˹���ɹ���Ŀ���Ȼ�ѧ����ʽ���ݴ˼��㷴Ӧ�ȣ�
��1���¶�Խ�߷�Ӧ����Խ�죬ѹǿһ��ʱ������ͼ���м��麬�����¶ȱ仯�����¶ȶ�ƽ���ƶ�Ӱ�죻
��2��ѹǿΪ2MPaʱ��ˮ̼��[
]Խ��ƽ��ʱCH4����ԽС���ݴ˻���CH4ƽ�⺬����ˮ̼��֮���ϵ���ߣ�
��3����������ʽ����ƽ��ʱ����ֵ�ƽ��Ũ�ȣ��ٸ���v=
��v��H2��������ƽ�ⳣ������ʽ������ƽ�ⳣ����
������������ԭ��Ӧ��������������õ��ӣ�����������������������
��1���¶�Խ�߷�Ӧ����Խ�죬ѹǿһ��ʱ������ͼ���м��麬�����¶ȱ仯�����¶ȶ�ƽ���ƶ�Ӱ�죻
��2��ѹǿΪ2MPaʱ��ˮ̼��[
| n(H2O) |
| n(CH4) |
��3����������ʽ����ƽ��ʱ����ֵ�ƽ��Ũ�ȣ��ٸ���v=
| ��c |
| ��t |
������������ԭ��Ӧ��������������õ��ӣ�����������������������
���
�⣺����֪����CO��g��+2H2��g��?CH3OH��g����H1
��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H2
��2H2��g��+O2��g��=2H2O��g����H3��
���ݸ�˹���ɣ��١�2-�ڡ�2+�۵�2CO��g��+O2��g��=2CO2��g�������䷴Ӧ�ȡ�H=2��H1-2��H2+��H3��
�ʴ�Ϊ��2��H1-2��H2+��H3��
����1�������������䣬�����¶ȣ���Ӧ���ʼӿ죬��ͼ���֪���¶�Խ�ߣ�����İٷֺ�����С��ƽ��������Ӧ�����ƶ���
�ʴ�Ϊ�������������䣬�����¶ȣ���Ӧ���ʼӿ죬ƽ��������Ӧ�����ƶ���
��2�������������䣬ѹǿΪ2MPaʱ��CH4ƽ�⺬����ˮ̼�ȵ��������С�����ϵ����Ϊ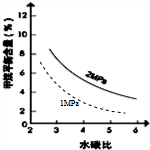 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3���μӷ�Ӧ��CH4Ϊ��1mol��80%=0.8mol����
CH4��g��+H2O��g��?CO��g��+3H2��g��
��ʼ��mol/L����1 1 0 0
�仯��mol/L����0.8 0.8 0.8 2.4
ƽ�⣨mol/L����0.2 0.2 0.8 2.4
����v��H2��=
=0.4 mol/��L?min����
�ʸ��¶��£�ƽ�ⳣ��=
=276.5��
��������ƽ������Ϊ0.4 mol/��L?min�������¶���ƽ�ⳣ��Ϊ276.5��
������������ԭ��Ӧ��������������õ��ӣ����������������������������缫��ӦʽΪ��O2+2H2O+4e-=4OH-��
�ʴ�Ϊ��O2+2H2O+4e-=4OH-��
��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H2
��2H2��g��+O2��g��=2H2O��g����H3��
���ݸ�˹���ɣ��١�2-�ڡ�2+�۵�2CO��g��+O2��g��=2CO2��g�������䷴Ӧ�ȡ�H=2��H1-2��H2+��H3��
�ʴ�Ϊ��2��H1-2��H2+��H3��
����1�������������䣬�����¶ȣ���Ӧ���ʼӿ죬��ͼ���֪���¶�Խ�ߣ�����İٷֺ�����С��ƽ��������Ӧ�����ƶ���
�ʴ�Ϊ�������������䣬�����¶ȣ���Ӧ���ʼӿ죬ƽ��������Ӧ�����ƶ���
��2�������������䣬ѹǿΪ2MPaʱ��CH4ƽ�⺬����ˮ̼�ȵ��������С�����ϵ����Ϊ
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
����3���μӷ�Ӧ��CH4Ϊ��1mol��80%=0.8mol����
CH4��g��+H2O��g��?CO��g��+3H2��g��
��ʼ��mol/L����1 1 0 0
�仯��mol/L����0.8 0.8 0.8 2.4
ƽ�⣨mol/L����0.2 0.2 0.8 2.4
����v��H2��=
| ||
| 6min |
�ʸ��¶��£�ƽ�ⳣ��=
| 0.8��2��43 |
| 0.2��0.2 |
��������ƽ������Ϊ0.4 mol/��L?min�������¶���ƽ�ⳣ��Ϊ276.5��
������������ԭ��Ӧ��������������õ��ӣ����������������������������缫��ӦʽΪ��O2+2H2O+4e-=4OH-��
�ʴ�Ϊ��O2+2H2O+4e-=4OH-��
����������Ƚ��ۺϣ��漰��Ӧ�ȼ��㡢��ѧƽ��ͼ��Ӱ�����ء���Ӧ������ƽ�ⳣ�����㡢ԭ��صȣ��ǶԻ���֪ʶ��Ӧ�ã�ע�����ո�˹���ɼ��㷴Ӧ�ȣ��Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
���и���������ָ����Һ�У�һ���д���������ǣ�������
| A��pH=0����Һ�У�Na+��[Al��OH��4]-��K+��NH4+ |
| B����ˮ�������c��H+��=10-12mol?L-1����Һ�У�C1-��HCO3-��NH4+��SO32- |
| C�������������H2����Һ�У�Mg2+��NH4+��Cl-��SO42- |
| D���μ�ʯ����Һ����ɫ����Һ��K+��Ba2+��NO3-��OH- |
��NA��ʾ�����ӵ�����ֵ������˵������ȷ���ǣ�������
| A����NA�������ӵ��������������22.4L |
| B��Na2O2��H2O��Ӧ��O2��ÿ����1 mol O2ת��4NA������ |
| C��1mol CH3OH��ȼ�ϵ�ظ���������Ӧʱ�õ�4NA������ |
| D��O��O1mol Mg�ڿ�������ȫȼ�գ�����MgO��Mg3N2��ת�Ƶ�������0.02NA |
��֪CuSO4��Һ�ֱ���Na2CO3��Һ��Na2S��Һ�ķ�Ӧ������£�
��1��CuSO4+Na2CO3��Ҫ��Cu2++CO32-+H2O��Cu��OH��2��+CO2����Ҫ��Cu2++CO32-��CuCO3��
��2��CuSO4+Na2S��Ҫ��Cu2++S2-��CuS����Ҫ��Cu2++S2-+2H2O��Cu��OH��2��+H2S��
���м������ʵ��ܽ�ȴ�С�ıȽ��У���ȷ���ǣ�������
��1��CuSO4+Na2CO3��Ҫ��Cu2++CO32-+H2O��Cu��OH��2��+CO2����Ҫ��Cu2++CO32-��CuCO3��
��2��CuSO4+Na2S��Ҫ��Cu2++S2-��CuS����Ҫ��Cu2++S2-+2H2O��Cu��OH��2��+H2S��
���м������ʵ��ܽ�ȴ�С�ıȽ��У���ȷ���ǣ�������
| A��Cu��OH��2��CuCO3��CuS |
| B��CuS��Cu��OH��2��CuCO3 |
| C��CuS��Cu��OH��2��CuCO3 |
| D��Cu��OH��2��CuCO3��CuS |
��֪��Ksp��RCl��=1.8��10-10��Ksp��RI��=1.5��10-16��Ksp��R2CrO4��=2.0��10-12�������������εı�����Һ�У�R+Ũ�ȴ�С˳����ȷ���ǣ�������
| A��RCl��RI��R2CrO4 |
| B��RCl��R2CrO4��RI |
| C��R2CrO4��RCl��RI |
| D��R2CrO4��RI��RCl |