题目内容
8.pH=2的盐酸和pH=2的稀硫酸相比较,下列说法正确的是( )| A. | 两溶液的物质的量浓度相同 | |
| B. | 两溶液的c(H+)相同 | |
| C. | 等体积的两溶液分别与足量Zn反应,产生H2的量不同 | |
| D. | 将两溶液均稀释100倍后,pH不同 |
分析 pH=2的盐酸和pH=2的稀硫酸溶液中,c(H+)=0.01mol/L,但由于是HCl是一元强酸,而硫酸是二元强酸,据此可知两酸溶液的浓度;由于溶液体积大小关系,可知溶液中的氢离子的物质的量大小关系,据此分析.
解答 解:A、pH=2的盐酸和pH=2的稀硫酸溶液中,c(H+)=0.01mol/L,但由于是HCl是一元强酸,而硫酸是二元强酸,据此可知两酸溶液的浓度之比为2;1,故A错误;
B、两溶液中c(H+)均为0.01mol/L,故B正确;
C、两溶液中c(H+)均为0.01mol/L,故等体积的两溶液中氢离子的物质的量相等,则和足量的锌反应产生的氢气的物质的量相等,故C错误;
D、由于都是强酸,故pH=2的盐酸和pH=2的稀硫酸溶液稀释100倍后,溶液的pH均变为4,故D错误.
故选B.
点评 本题考查学生的分析能力和元素化合物知识的应用能力,为高考常见题型,难度中等,注意硫酸是二元强酸,而盐酸是一元强酸,难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
16.下列几种试剂不能把浓度均为0.1mol•L-1的Na2CO3、NaHCO3鉴别开的是( )
| A. | 0.1 mol•Lˉ1BaCl2溶液 | B. | 澄清石灰水 | ||
| C. | 稀盐酸 | D. | pH试纸 |
3.有如下四种碳架结构的烃,下列描述不正确的是( )
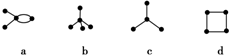

| A. | a和d互为同分异构体 | B. | b和c是同系物 | ||
| C. | a和d都能发生加成反应 | D. | b、c、d都能发生取代反应 |
10.下列实验操作能达到目的是( )
①用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体
②用加热蒸发K2CO3溶液的方法获得K2CO3晶体
③用Na2S溶液和CuSO4溶液反应制取CuS固体
④加热MgCl2溶液制取MgCl2固体.
①用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体
②用加热蒸发K2CO3溶液的方法获得K2CO3晶体
③用Na2S溶液和CuSO4溶液反应制取CuS固体
④加热MgCl2溶液制取MgCl2固体.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①③ |
7.下列实验能达到目的是( )
| A. | 用饱和Na2CO3溶液除去混在CO2中的HCl气体 | |
| B. | 用Cl2除去Fe2(SO4)3溶液中的少量FeSO4 | |
| C. | 用加热的方法除去混在碳酸钠固体中的碳酸氢钠杂质 | |
| D. | 向AlCl3溶液中加入过量的NaOH溶液以制备Al(OH)3 |
8.下列关于物质的量、摩尔质量的叙述正确的是( )
| A. | 0.012 kg 12C中含有约6.02×1023个碳原子 | |
| B. | 1 mol H2O中含有2 mol氢和1 mol氧 | |
| C. | 物质的量就是1 mol物质的质量 | |
| D. | 2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 |
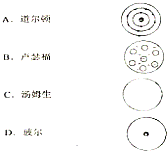 (1)将下列科学家与他们的原子结构模型(如图)用线连接起来:
(1)将下列科学家与他们的原子结构模型(如图)用线连接起来: