题目内容
18.已知:H2(g)+O2(g)═H2O(g),反应过程中能量变化如右图,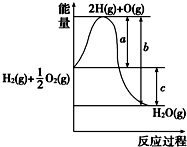
问:
(1)a、b、c分别代表什么意义?
a代表旧键断裂吸收的能量;b代表生成新键放出的能量;c代表反应热.
(2)该反应是放热反应还是吸热反应?放热.
△H大于零还是小于零?小于零.
(3)若已知2H2(g)+O2(g)═2H2O(g)△H1=-Q1kJ•mol-1;2H2(g)+O2(g)═2H2O(l)△H2=-Q2 kJ•mol-1,则△H1>△H2.(填“>”、“<”或“=”)
(4)发射卫星时可用肼(N2H4)作燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知:N2(g)+2O2(g)═2NO2(g)△H1=+67.7 kJ/mol;N2H4(g)+O2(g)═N2(g)+2H2O(g)△H2=-534 kJ/mol.试计算1 mol 肼和二氧化氮完全反应时放出的热量为567.85kJ;写出肼与二氧化氮反应的热化学方程式:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7 kJ/mol.
分析 (1)依据化学反应的反应热可以根据反应的实质分析,断裂化学键吸收能量,生成化学键放出能量,二者的差值是反应的反应热;
(2)依据反应物和生成物的能量高低和反应的能量守恒分析判断;
(3)物质的聚集状态不同,能量不同,物质由气体变成液体要放出能量,反之吸收能量,以此解答该题;
(4)依据热化学方程式和盖斯定律计算得到所需热化学方程式,反应的热化学方程式改变系数,焓变随之改变,通过热化学方程式之间的加减计算得到.
解答 解:(1)图象中可以分析判断,a代表旧键断裂吸收的能量;c为反应生成化学键放出的热量减去反应断裂化学键吸收的热量,即c代表反应热;
故答案为:a代表旧键断裂吸收的能量;b代表生成新键放出的能量;c代表反应热;
(2)反应物的能量高于生成物的能量,依据化学反应的能量守恒,反应是放热反应,焓变小于0;
故答案为:放热;小于零;
(3)物质由气体变成液体要放出能量,则肯定是生成液态水比生成气态水放出的能量多,则Q1<Q2,
或由盖斯定律判断,已知反应①2H2(g)+O2(g)═2H2O(g)△H=-Q1kJ•mol-1 ;②2H2(g)+O2(g)═2H2O(l)△H=-Q2kJ•mol-1,
①-②可的2H2O(l)═2H2O(g)△H=(Q2-Q1)kJ•mol-1,因液体变成气体要吸热,则△H>0,所以△H1 >△H2,故答案为:>;
(4)①N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol
依据盖斯定律:②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol,
所以1mol肼和二氧化氮完全反应时放出的热量为$\frac{1135.7}{2}$=567.85kJ;
故答案为:567.85;2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7 kJ/mol.
点评 本题考查反应热的大小比较,侧重于学生的分析能力的考查,注意把握反应热大小比较的角度,难度不大.

| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
| A. | FeCl3溶液 | B. | Ca(OH)2饱和溶液 | C. | CuSO4溶液 | D. | 盐酸 |
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(已知:I2+2S2O32-=S4O62-+2I-).
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是蓝色褪去,溶液中30s内不恢复原色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.

| A. | N2(g)+3H2(g)?2NH3(g);△H=2(b-a) kJ/mol | |
| B. | N2(g)+3H2(g)?2NH3(l);△H=2(a-b-c) kJ/mol | |
| C. | $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(l);△H=(b+c-a) kJ/mol | |
| D. | $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g);△H=(a+b) kJ/mol |
| A. | 两溶液的物质的量浓度相同 | |
| B. | 两溶液的c(H+)相同 | |
| C. | 等体积的两溶液分别与足量Zn反应,产生H2的量不同 | |
| D. | 将两溶液均稀释100倍后,pH不同 |
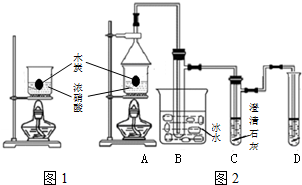 浓硝酸是一种常见的酸,加热或见光易分解生成NO2.某实验小组欲探究碳与浓硝酸的反应情况.实验装置如图.回答下列问题:
浓硝酸是一种常见的酸,加热或见光易分解生成NO2.某实验小组欲探究碳与浓硝酸的反应情况.实验装置如图.回答下列问题: