题目内容
对于2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1热化学方程式的下列说法正确的是( )
| A、氢气与氧气反应放出483.6kJ 热量 |
| B、氢气与氧气反应生成1mol 水蒸气时放出483.6kJ 热量 |
| C、2个H2分子燃烧生成水蒸气放出483.6kJ |
| D、2molH2与1molO2生成2mol水蒸气放出483.6kJ热量 |
考点:热化学方程式
专题:化学反应中的能量变化
分析:据氢气燃烧的热化学方程式分析可知,2mol氢气与1mol氧气燃烧生成2mol水蒸气放热483.6kJ,热化学方程式中化学方程式计量数只表示物质的量不表示微粒个数,据此回答.
解答:
解:A、依据热化学方程式可知,2mol氢气和1mol氧气恰好完全反应放热483.6kJ,反应热和系数以及状态有关,故A错误;
B、反应热和系数成正比关系,氢气与氧气反应生成1mol 水蒸气时放出241.8kJ的热量,故B错误;
C、热化学方程式中化学方程式计量数只表示物质的量不表示微粒个数,故C错误;
D、2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1热化学方程式表示2mol氢气与1mol氧气燃烧生成2mol水蒸气放热483.6kJ,故D正确.
故选D.
B、反应热和系数成正比关系,氢气与氧气反应生成1mol 水蒸气时放出241.8kJ的热量,故B错误;
C、热化学方程式中化学方程式计量数只表示物质的量不表示微粒个数,故C错误;
D、2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1热化学方程式表示2mol氢气与1mol氧气燃烧生成2mol水蒸气放热483.6kJ,故D正确.
故选D.
点评:本题考查了热化学方程式的分析判断,化学反应能量变化和热化学方程式的表达意义是解题关键,题目较简单.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
l体积某气态烃完全燃烧需消耗相同条仵下3体积O2,该气态烃是( )
| A、CH4 |
| B、C2H2 |
| C、C2H4 |
| D、C3H6 |
已知甲、乙、丙、丁四种物质均含A元素,A是第3周期最活泼的金属元素,甲为单质.它们之间有如图所示转化关系(转化过程中部分物质未标出).甲
乙
丙
丁写出A的原子结构示意图 ;丁的化学式 .
| H2O |
| CO2 |
| CO2 |
据统计,约有80%~85%的化工生产过程使用催化剂,同样在化学实验室进行物质的制备时,也同样用到催化剂.以下反应不需用催化剂能顺利进行的是( )
| A、工业合成氨 |
| B、工业上用氯气制取漂白粉 |
| C、工业制硫酸 |
| D、实验室制取溴苯 |
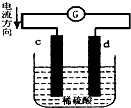 如图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c、d为两个电极.则下列有关的判断不正确的是( )
如图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c、d为两个电极.则下列有关的判断不正确的是( )| A、d为负极,发生氧化反应 |
| B、c为锌片,电池工作时,溶液中SO42-向c移动 |
| C、电池工作的过程中,d电极上产生大量的气泡 |
| D、电池工作的过程中,溶液中SO42-浓度基本不变 |
已知草酸钠与高锰酸钾反应的化学方程式为:5Na2C2O4+2KMnO4+8H2SO4═l0CO2↑+2MnSO4+K2SO4+8H2O+5Na2SO4.下列有关说法中正确的是( )
| A、H2SO4含有离子键和共价键 |
| B、Na2C2O4被还原 |
| C、标准状况下,每转移l mol电子生成11.2L的混合气体 |
| D、CO2只含极性键 |
下列各项中,正确的是( )
A、N2分子的电子式: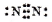 |
B、H原子的结构示意图: |
C、O2分子的比例模型: |
| D、乙烷分子的结构式:C2H6 |
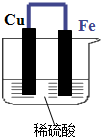 如图示的装置中
如图示的装置中