题目内容
下列各项中,正确的是( )
A、N2分子的电子式: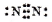 |
B、H原子的结构示意图: |
C、O2分子的比例模型: |
| D、乙烷分子的结构式:C2H6 |
考点:电子式、化学式或化学符号及名称的综合
专题:化学用语专题
分析:A.氮气分子中存在氮氮三键,氮原子最外层达到8电子稳定结构;
B.氢原子的核电荷数=核外电子总数=1,最外层为1个电子;
C.氧气分子中,两个氧原子的半径相等, 中两个原子大小不同,不能表示氧气;
中两个原子大小不同,不能表示氧气;
D.乙烷为含有2个碳原子的烷烃,结构式中应该将所有共价键用短线表示.
B.氢原子的核电荷数=核外电子总数=1,最外层为1个电子;
C.氧气分子中,两个氧原子的半径相等,
 中两个原子大小不同,不能表示氧气;
中两个原子大小不同,不能表示氧气;D.乙烷为含有2个碳原子的烷烃,结构式中应该将所有共价键用短线表示.
解答:
解:A.氮气中含有氮氮三键,氮原子最外层为8个电子,氮气的电子式为: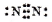 ,故A正确;
,故A正确;
B.氢原子的核电荷数与核外电子总数都是1,氢原子正确的原子结构示意图为: ,故B错误;
,故B错误;
C.氧气分子中的两个氧原子比较相等,氧气正确的比例模型为: ,故C错误;
,故C错误;
D.乙烷分子中含有两个甲基,CH3CH3为乙烷的结构简式,乙烷的结构式为: ,故D错误;
,故D错误;
故选A.
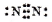 ,故A正确;
,故A正确;B.氢原子的核电荷数与核外电子总数都是1,氢原子正确的原子结构示意图为:
 ,故B错误;
,故B错误;C.氧气分子中的两个氧原子比较相等,氧气正确的比例模型为:
 ,故C错误;
,故C错误;D.乙烷分子中含有两个甲基,CH3CH3为乙烷的结构简式,乙烷的结构式为:
 ,故D错误;
,故D错误;故选A.
点评:本题考查了结构式、比例模型、原子结构示意图、电子式的书写方法判断,题目难度中等,注意掌握常见化学用语的概念及正确的表示方法,明确结构式与结构简式、分子式、电子式的区别.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
对于2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1热化学方程式的下列说法正确的是( )
| A、氢气与氧气反应放出483.6kJ 热量 |
| B、氢气与氧气反应生成1mol 水蒸气时放出483.6kJ 热量 |
| C、2个H2分子燃烧生成水蒸气放出483.6kJ |
| D、2molH2与1molO2生成2mol水蒸气放出483.6kJ热量 |
下列反应中,属于加成反应的是( )
A、CH3CH2OH+CH3COOH
| |||
B、2CH3CHO+O2
| |||
| C、CH3-CH═CH2+Br2→CH3-CHBr-CH2Br | |||
D、 +Br2 +Br2
 +HBr +HBr |
下列说法中正确的是( )
| A、摩尔是国际单位制中把宏观物质的质量与微观粒子的数目联系起来的一个物理量 |
| B、摩尔是物质的量的单位,简称摩,符号为mol |
| C、摩尔质量就是该物质的相对分子质量或相对原子质量 |
| D、阿伏加德罗常数为6.02×1023 |
下列说法正确的是( )
| A、等体积、等物质的量浓度的强酸中所含的H+数目一定相等 |
| B、标准状况下,6.02×1023个分子所占的体积约是22.4 L |
| C、同温同压下,相同体积的物质,它们的物质的量必定相等 |
| D、任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必定相等 |
常温下,下列溶液中可能大量共存的离子组是( )
| A、加入金属镁能产生H2的溶液中:Na+、Fe2+、SO42-、NO3- |
| B、含有大量Fe2+的溶液中:K+、Mg2+、ClO-、SO42- |
| C、能使Al3+生成沉淀的溶液中:NH4+、Na+、SiO32-、HCO3- |
| D、水电离产生的c(OH-)=1×10-10mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |
25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是( )(填序号)
| A、氨水与氯化铵发生化学反应 |
| B、氯化铵溶液水解显酸性,增加了c(H+) |
| C、氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH-)减小 |
下列过程中,共价键被破坏的是( )
| A、碘升华 |
| B、溴蒸气被木炭吸附 |
| C、蔗糖溶于水 |
| D、氯化氢气体溶于水 |