题目内容
已知草酸钠与高锰酸钾反应的化学方程式为:5Na2C2O4+2KMnO4+8H2SO4═l0CO2↑+2MnSO4+K2SO4+8H2O+5Na2SO4.下列有关说法中正确的是( )
| A、H2SO4含有离子键和共价键 |
| B、Na2C2O4被还原 |
| C、标准状况下,每转移l mol电子生成11.2L的混合气体 |
| D、CO2只含极性键 |
考点:氧化还原反应,离子化合物的结构特征与性质,共价键的形成及共价键的主要类型
专题:氧化还原反应专题,化学键与晶体结构
分析:5Na2C2O4+2KMnO4+8H2SO4═l0CO2↑+2MnSO4+K2SO4+8H2O+5Na2SO4中,Mn元素的化合价降低,C元素的化合价升高,以此来解答.
解答:
解:A.H2SO4含有共价键,不含离子键,故A错误;
B.C元素的化合价升高,失去电子,则Na2C2O4被氧化,故B错误;
C.由反应可知,转移10mol电子生成10mol气体,则标准状况下,每转移l mol电子生成22.4L的混合气体,故C错误;
D.CO2只含C、O元素之间的极性键,故D正确;
故选D.
B.C元素的化合价升高,失去电子,则Na2C2O4被氧化,故B错误;
C.由反应可知,转移10mol电子生成10mol气体,则标准状况下,每转移l mol电子生成22.4L的混合气体,故C错误;
D.CO2只含C、O元素之间的极性键,故D正确;
故选D.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、化学键的判断为解答的关键,注重分析与应用能力的考查,题目难度不大.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
下列实验方案设计正确的是( )
| A、分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤 |
| B、失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氯化铝溶液,可以用碳酸铵溶液鉴别 |
| C、将MgCl2溶液在蒸发皿中加热蒸干,得到无水MgCl2固体 |
| D、检验从火星上带回来的红色物体是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
对于2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1热化学方程式的下列说法正确的是( )
| A、氢气与氧气反应放出483.6kJ 热量 |
| B、氢气与氧气反应生成1mol 水蒸气时放出483.6kJ 热量 |
| C、2个H2分子燃烧生成水蒸气放出483.6kJ |
| D、2molH2与1molO2生成2mol水蒸气放出483.6kJ热量 |
海南的水果大量向北方销售,运输这些水果时,常常将浸泡有高锰酸钾溶液的硅藻土放置在盛放水果的集装箱中,高锰酸钾溶液的作用是 ( )
| A、杀死水果周围的细菌,防止水果霉变 |
| B、吸收水果周围的氧气,防止水果腐烂 |
| C、吸收水果产生的乙烯,防止水果早熟 |
| D、发挥氧化性,催熟水果 |
下列说法或表示方法中正确的是( )
| A、等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多 |
| B、氢气的标准燃烧热为285.8 kJ?mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ?mol-1 |
| C、Ba(OH)2?8H2O(s)+2NH4Cl(s)═BaCl2(s)+2NH3(g)+10H2O(l)△H<0 |
| D、已知中和反应的反应热△H=-57.3 kJ?mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ |
下列反应中,属于加成反应的是( )
A、CH3CH2OH+CH3COOH
| |||
B、2CH3CHO+O2
| |||
| C、CH3-CH═CH2+Br2→CH3-CHBr-CH2Br | |||
D、 +Br2 +Br2
 +HBr +HBr |
25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是( )(填序号)
| A、氨水与氯化铵发生化学反应 |
| B、氯化铵溶液水解显酸性,增加了c(H+) |
| C、氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH-)减小 |




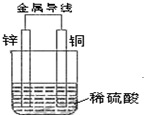 根据如图填空(涉及到电极填写具体物质的元素符号)
根据如图填空(涉及到电极填写具体物质的元素符号)