题目内容
相同条件,等物质的量的乙醇、乙二醇、丙三醇中分别加入足量的金属钠产生氢气的体积之比是( )
| A、2:3:6 |
| B、6:3:2 |
| C、3:2:1 |
| D、1:2:3 |
考点:化学方程式的有关计算
专题:
分析:醇中羟基与钠反应生成氢气,各醇的物质的量相等,根据H原子守恒,生成氢气的物质的量之比为醇中羟基数目之比,相同条件下气体体积之比等于其物质的量之比.
解答:
解:乙醇、乙二醇、丙三醇分别有1、2、3个羟基,羟基与Na反应生成氢气,即羟基中H原子转化生成氢气,乙醇、乙二醇、丙三醇物质的量相等,根据H原子守恒,生成氢气的物质的量之比为1:2:3,相同条件下气体体积之比等于其物质的量之比,故生成氢气的体积之比为1:2:3,
故选D.
故选D.
点评:本题考查化学方程式有关计算,理解醇与Na反应本质是关键,利用守恒法计算,避免利用方程式计算的繁琐.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
化学家从反应C2H6(g)+Cl2(g)→C2H5Cl(l)+HCl(g)中受到启发,提出在农药和有机合成工业中可获得副产品盐酸,这一设想已成为现实.试指出从上述反应体系中得到盐酸可采用的分离方法是( )
| A、蒸馏法 | B、水洗法 |
| C、分液法 | D、过滤法 |
一些烷烃的燃烧热如下表:下列表述正确的是( )
| 化合物 | 燃烧热/kJ?mol-1 | 化合物 | 燃烧热/kJ?mol-1 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
| A、正戊烷的燃烧热大约在3520 kJ?mol-1左右 |
| B、热稳定性:正丁烷<异丁烷 |
| C、乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g);△H=-1560.8kJ?mol-1 |
| D、相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
硝酸参加下列反应,既体现出酸性,又体现出氧化性的是( )
| A、Cu |
| B、Fe2O3 |
| C、C |
| D、NaOH |
 2008年北京奥运会主体育场的外形好似“鸟巢”(The Bird Nest).有一类硼烷也好似鸟巢,故称为巢式硼烷.巢式硼烷除B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化.如图是三种巢式硼烷,有关说法正确的是( )
2008年北京奥运会主体育场的外形好似“鸟巢”(The Bird Nest).有一类硼烷也好似鸟巢,故称为巢式硼烷.巢式硼烷除B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化.如图是三种巢式硼烷,有关说法正确的是( )| A、这类巢式硼烷的通式是BnHn+4 | ||||
B、2B5H9+12O2
| ||||
| C、8个硼原子的巢式硼烷化学式应为B8H10 | ||||
| D、硼烷与水反应是非氧化还原反应 |
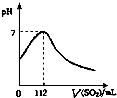 在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为( )
在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为( )| A、0.5 mol?L─1 |
| B、0.05 mol?L─1 |
| C、1 mol?L─1 |
| D、0.1 mol?L─1 |
下列离子方程式正确的是( )
| A、碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
| B、向次氯酸钙溶液中通入过量二氧化硫Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C、向硫酸氢钠溶液中滴入氢氧化钡溶液至中性H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D、将氢氧化铁粉末加入氢碘酸:Fe(OH)3+3H=Fe3++3H2O |

 合成
合成 .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)