题目内容
某化学研究性学习小组在研究 KClO3 制取氧气实验时查得如下资料:
资料一:KClO3 单独加热到363℃时熔融,在380℃时发生两个反应:①4KClO3=3KClO4+KCl
②2KClO3=2KCl+3O2↑ 加热至400℃以上时KClO4 又发生分解,放出大量的O2.
资料二:若用MnO2 作催化剂,则KClO3 在200℃时就能迅速分解,但制得的氧气中有氯气的气味,生成的氯化钾又略带紫红色,认为反应过程如下:③2KClO3+2MnO2=2KMnO4+Cl2↑+O2↑ ④2KMnO4=K2MnO4+MnO2+O2↑⑤Cl2+K2MnO4=2KCl+MnO2+O2↑
资料三:部分物质的物理性质
请回答下列问题
(1)在KClO3 与 KClO4 中,热稳定性较好的是
(2)单独加热KClO3 制取氧气时,试管口应稍向 (填“上”或“下”)倾斜,证明生成物中有KCl 的方法是: .假设资料一中只发生反应①,则证明有KClO4 生成的实验方法是 .
(3)若用MnO2 作催化剂制取氧气时,反应③中氧化产物是 (填化学式),按该反应过程,若制取1.5molO2,总共有 mol电子发生转移.
(4)若用MnO2 作催化剂加热KClO3 时,两者质量比以MnO2 占
为最好.若用占
的 MnO2 和KClO3共热时,开始放出氧气较慢,继续加热至一定温度时,放出氧气的速率会很快,其主要原因可能是 .
资料一:KClO3 单独加热到363℃时熔融,在380℃时发生两个反应:①4KClO3=3KClO4+KCl
②2KClO3=2KCl+3O2↑ 加热至400℃以上时KClO4 又发生分解,放出大量的O2.
资料二:若用MnO2 作催化剂,则KClO3 在200℃时就能迅速分解,但制得的氧气中有氯气的气味,生成的氯化钾又略带紫红色,认为反应过程如下:③2KClO3+2MnO2=2KMnO4+Cl2↑+O2↑ ④2KMnO4=K2MnO4+MnO2+O2↑⑤Cl2+K2MnO4=2KCl+MnO2+O2↑
资料三:部分物质的物理性质
| 物质 | 颜色和状态 | 密度/g?cm3 | 0℃时溶解度/g | 100℃时溶解度/g |
| KCl | 无色晶体 | 1.98 | 27.6 | 56.7 |
| KClO3 | 无色晶体 | 2.32 | 3.3 | 57 |
| KClO4 | 无色晶体 | 2.32 | 0.75 | 21.8 |
(1)在KClO3 与 KClO4 中,热稳定性较好的是
(2)单独加热KClO3 制取氧气时,试管口应稍向
(3)若用MnO2 作催化剂制取氧气时,反应③中氧化产物是
(4)若用MnO2 作催化剂加热KClO3 时,两者质量比以MnO2 占
| 1 |
| 3 |
| 1 |
| 10 |
考点:性质实验方案的设计
专题:实验设计题
分析:(1)根据氯酸钾受热分解生成高氯酸钾判断二者稳定性;
(2)从防水蒸汽回流角度考虑;用硝酸银和稀硝酸来检验氯离子;根据氯酸钾和高氯酸钾溶解度的不同选择溶解方法检验;
(3)根据化合价变化判断氧化产物;根据反应方程式判断生成一定量氧气转移电子数,进而计算生成1.5mol氧气转移电子数;
(4)二氧化锰为催化剂,二氧化锰过少说明没与氯酸钾充分接触,后来反应速率加快,二氧化锰量没变,只能是反应物状态发生变化,接触充分.
(2)从防水蒸汽回流角度考虑;用硝酸银和稀硝酸来检验氯离子;根据氯酸钾和高氯酸钾溶解度的不同选择溶解方法检验;
(3)根据化合价变化判断氧化产物;根据反应方程式判断生成一定量氧气转移电子数,进而计算生成1.5mol氧气转移电子数;
(4)二氧化锰为催化剂,二氧化锰过少说明没与氯酸钾充分接触,后来反应速率加快,二氧化锰量没变,只能是反应物状态发生变化,接触充分.
解答:
解:(1)因加热时,①4KClO3=3KClO4+KCl,②2KClO3=2KCl+3O2↑,故热稳定性较好的为高氯酸钾,故答案为:KClO4;
(2)样品不干燥,加热过程中可能产生蒸馏水,防止水蒸汽回流炸裂试管,故试管口稍向上倾斜,证明含氯化钾,即是检验氯离子,可用硝酸银来检验,具体操作为:将生成物配成溶液,取少量放入试管,加入AgNO3溶液,有不溶于HNO3的白色沉淀生成,证明生成物中有KCl;从所给物质的溶解度可知,0℃时,氯酸钾和高氯酸钾溶解度相差较大,故可取3.3g氯酸钾两份,一份溶于100g0℃水,另一份加热到380℃,冷却研细后再溶于100g0℃水,若有白色不溶物,证明生成了高氯酸钾,
故答案为:上; 将生成物配成溶液,加入AgNO3溶液,有不溶于HNO3的白色沉淀生成,证明生成物中有KCl;取两份相同质量的KClO3(各3.3g),一份溶于100g0℃的水中,另一份加热到380℃,冷却后,取出研细,溶于100g0℃的水中,振荡,有白色不溶物,证明有KClO4生成;
(3)2KClO3+2MnO2=2KMnO4+Cl2↑+O2↑ 中,Mn元素化合价从+2价升为+7价,故高锰酸钾为氧化产物,O元素化合价从-2价升为0价,故氧气也为氧化产物;
反应③生成1mol氧气转移,转移10mol电子,反应④中生成1mol氧气转移4mol电子,反应⑤中生成1mol氧气转移4mol电子,故按资料二,生成3mol氧气转移10+4+4=18mol电子,则生成1.5mol氧气转移9mol电子,
故答案为:KMnO4和O2;9;
(4)二氧化锰为催化剂,二氧化锰过少说明没与氯酸钾充分接触,后来反应速率加快,二氧化锰量没变,只能是反应物状态发生变化,接触充分,
故答案为:MnO2的质量占1/10时,在开始时KClO3与MnO2接触少,放出的氧气慢且少,加热至KClO3熔融与MnO2广泛接触,释放出氧气速率会加快.
(2)样品不干燥,加热过程中可能产生蒸馏水,防止水蒸汽回流炸裂试管,故试管口稍向上倾斜,证明含氯化钾,即是检验氯离子,可用硝酸银来检验,具体操作为:将生成物配成溶液,取少量放入试管,加入AgNO3溶液,有不溶于HNO3的白色沉淀生成,证明生成物中有KCl;从所给物质的溶解度可知,0℃时,氯酸钾和高氯酸钾溶解度相差较大,故可取3.3g氯酸钾两份,一份溶于100g0℃水,另一份加热到380℃,冷却研细后再溶于100g0℃水,若有白色不溶物,证明生成了高氯酸钾,
故答案为:上; 将生成物配成溶液,加入AgNO3溶液,有不溶于HNO3的白色沉淀生成,证明生成物中有KCl;取两份相同质量的KClO3(各3.3g),一份溶于100g0℃的水中,另一份加热到380℃,冷却后,取出研细,溶于100g0℃的水中,振荡,有白色不溶物,证明有KClO4生成;
(3)2KClO3+2MnO2=2KMnO4+Cl2↑+O2↑ 中,Mn元素化合价从+2价升为+7价,故高锰酸钾为氧化产物,O元素化合价从-2价升为0价,故氧气也为氧化产物;
反应③生成1mol氧气转移,转移10mol电子,反应④中生成1mol氧气转移4mol电子,反应⑤中生成1mol氧气转移4mol电子,故按资料二,生成3mol氧气转移10+4+4=18mol电子,则生成1.5mol氧气转移9mol电子,
故答案为:KMnO4和O2;9;
(4)二氧化锰为催化剂,二氧化锰过少说明没与氯酸钾充分接触,后来反应速率加快,二氧化锰量没变,只能是反应物状态发生变化,接触充分,
故答案为:MnO2的质量占1/10时,在开始时KClO3与MnO2接触少,放出的氧气慢且少,加热至KClO3熔融与MnO2广泛接触,释放出氧气速率会加快.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重反应机理的考查,题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
在某温度下测得纯水中的c(H+)=2.4×10-7mol?L-1,则c(OH-)为( )
| A、2.4×10-7mol?L-1 | ||
| B、0.14×10-7mol?L-1 | ||
C、
| ||
| D、无法确定 |
相同条件,等物质的量的乙醇、乙二醇、丙三醇中分别加入足量的金属钠产生氢气的体积之比是( )
| A、2:3:6 |
| B、6:3:2 |
| C、3:2:1 |
| D、1:2:3 |
能正确表示下列反应的离子方程式是( )
| A、铁跟硫酸铜溶液反应:2Fe+3Cu2+=2Fe3++3Cu |
| B、饱和石灰水跟稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| C、在碳酸氢钙溶液中加入盐酸:CO32-+2H+=CO2↑+H2O |
| D、在澄清石灰水里通入过量二氧化碳:OH-+CO2=HCO3- |
下列离子方程式中,正确的是( )
| A、NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O |
| B、FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl- |
| C、NaNO2溶液加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O |
| D、Fe(NO3)3溶液加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
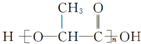 ,有关W的信息如图,据此回答下列问题:
,有关W的信息如图,据此回答下列问题: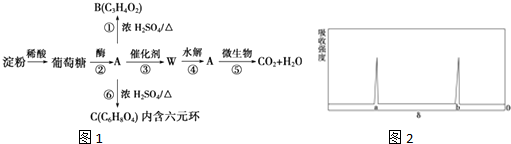
 ; ②
; ② ,有机物A的水溶液显酸性,遇 FeCl3不显色,苯环上的一氯代物只有两种结构.试根据图中各有机物的相互转化关系回答:
,有机物A的水溶液显酸性,遇 FeCl3不显色,苯环上的一氯代物只有两种结构.试根据图中各有机物的相互转化关系回答: