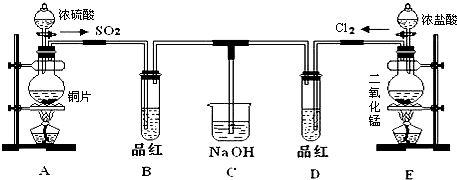
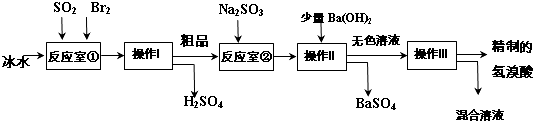
题目内容
16.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为吸热反应.(填“吸热”或“放热”)
(2)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)=0.01mol/L,c(H2O)=0.03mol/L,
c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率小(填“大”“小”或“不能确定”)
(3)1000℃时,向该容器中通入CO2和H2进行上述反应,能说明该反应达平衡状态的是B
A.容器中压强不变 B.混合气体中c(CO)不变 C.混合气体的密度不变 D.c(CO)=c(CO2)
E.化学平衡常数K不变 F.单位时间内生成CO的分子数与生成H2O的分子数相等.
分析 (1)由表中数据可知,温度越高化学平衡常数越大,升高温度平衡向正反应移动,正反应是吸热反应;
(2)计算此时的浓度商Qc,与平衡常数比较判断反应进行方向,据此解答;
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断.
解答 解:(1)由表中数据可知,温度越高化学平衡常数越大,升高温度平衡向正反应移动,正反应是吸热反应,
故答案为:吸热;
(2)此时的浓度商Qc=$\frac{0.01×0.03}{0.01×0.05}$=0.6,小于平衡常数0.9,故反应向正反应进行,故H2O的消耗速率比生成速率小,
故答案为:小;
(3)CO2(g)+H2(g)?CO(g)+H2O(g),反应是吸热反应,
A.反应前后气体体积不变,容器中压强始终不变,故A错误;
B.混合气体中c(CO)不变是平衡标志,故B正确;
C.反应前后气体质量和体积不变,混合气体的密度始终不变,不能说明反应达到平衡状态,故c错误;
D.起始量和变化量有关,c(CO)=c(CO2)不能说明反应达到平衡状态,故D错误;
E.温度不变化学平衡常数K不变,不能说明反应达到平衡状态,故E错误;
F.单位时间内生成CO的分子数与生成H2O的分子数始终相等,不能说明反应达到平衡状态,故F错误;
故答案为:B.
点评 本题考查了反应速率的计算、化学平衡常数计算、平衡标志的判断方法、影响平衡的因素等,图象分析是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.分类方法在化学学科的发展中起到重要的作用,下列完全正确的是( )
| A | B | C | D | |
| 强电解质 | AgCl | SO3 | 醋酸 | 熔融NaOH |
| 弱电解质 | 晶体桂 | BaSO4 | HF | Fe(OH)3 |
| 非电解质 | CH4 | 液氨 | C2H5OH | C02 |
| A. | A | B. | B | C. | C | D. | D |
4.下列关于食品添加剂的说法,不正确的是( )
| A. | 醋可同时用作防腐剂和调味剂 | |
| B. | 食品添加剂必须用天然物质制造 | |
| C. | 柠檬黄常用作着色剂,改善食品色泽 | |
| D. | 食品添加剂在合理限量范围内使用是可以的 |
11.学习化学有利于我们认识饮食与健康的关系,养成良好的饮食习惯.

(1)油脂被摄人人体后,在酶的作用下水解为高级脂肪酸(写名称,下同)和甘油,
进而被氧化生成二氧化碳、水并提供能量,或作为合成人体所需其他物质的原料.
(2)发育出现障碍,患营养缺乏症,这主要是由于摄取蛋白质(填“蛋白质”、“脂肪”或“糖类”)不足引起的.下列食物中富含该物质的是C(填字母).
A菠菜 B花生油 C瘦肉 D西瓜
(3)某火腿制品的包装上印有相关配料:精选瘦肉、白糖、淀粉、亚硝酸钠等.火腿中属于防腐剂的是亚硝酸钠,不可长期或大量进食腌制肉类食品的原因是:亚硝酸钠与肉类的蛋白质反应,生成一种致癌物其包装袋上常可看到如图1所示的图
标,它的含义是可回收物,此包装袋材料是聚乙烯塑料,它的单体是CH2=CH2(填结构简式).
(4)如图2所示4支试管同时水浴加热4min.为检验其中淀粉的水解程度,某同学的实验操
作与现象记录如下:
①结合试管1、2中的现象,得出的结论是:这两支试管中淀粉没有水解(填“没有”、“部分”或“全部”),淀粉没有(填“有”或“没有”)还原性.
②结合试管3、4中的现象,不能(填“能”或“不能”)得出“这两支试管中淀粉没有水解”的结论,理由是银镜反应须在碱性环境中进行,未用NaOH溶液中和硫酸.

(1)油脂被摄人人体后,在酶的作用下水解为高级脂肪酸(写名称,下同)和甘油,
进而被氧化生成二氧化碳、水并提供能量,或作为合成人体所需其他物质的原料.
(2)发育出现障碍,患营养缺乏症,这主要是由于摄取蛋白质(填“蛋白质”、“脂肪”或“糖类”)不足引起的.下列食物中富含该物质的是C(填字母).
A菠菜 B花生油 C瘦肉 D西瓜
(3)某火腿制品的包装上印有相关配料:精选瘦肉、白糖、淀粉、亚硝酸钠等.火腿中属于防腐剂的是亚硝酸钠,不可长期或大量进食腌制肉类食品的原因是:亚硝酸钠与肉类的蛋白质反应,生成一种致癌物其包装袋上常可看到如图1所示的图
标,它的含义是可回收物,此包装袋材料是聚乙烯塑料,它的单体是CH2=CH2(填结构简式).
(4)如图2所示4支试管同时水浴加热4min.为检验其中淀粉的水解程度,某同学的实验操
作与现象记录如下:
| 试管 | 操作 | 现象 |
| 1 | 加入碘水 | 溶液变成蓝色 |
| 2 | 加入银氨溶液,水浴加热 | 未出现银镜 |
| 3 | 加入碘水 | 溶液变成蓝色 |
| 4 | 加入银氨溶液,水浴加热 | 未出现银镜 |
②结合试管3、4中的现象,不能(填“能”或“不能”)得出“这两支试管中淀粉没有水解”的结论,理由是银镜反应须在碱性环境中进行,未用NaOH溶液中和硫酸.
1.下列叙述正确的是( )
| A. | SO2和SO3都是酸性氧性物,二者的水溶液都是强酸 | |
| B. | 将足量的SO2通入BaCl2溶液中可生成白色沉淀 | |
| C. | 检验SO2中是否含有CO2的方法是通过澄清的石灰水 | |
| D. | 向含有BaCl2和NaOH的混合溶液中通入少量SO2气体,有白色沉淀生成 |
8.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 标准状况下,33.6 LSO3中含有氟原子的数目为1.5NA | |
| B. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| C. | 7.8 g Na2O2中含有的阴离子数为0.2NA | |
| D. | 1 molCl2参加反应转移电子数一定为2NA |
5.下列各组离子中,在给定条件下能大量共存的是( )
| A. | 通入足量的二氧化碳后的溶液中Na+、$Al{O_2}^-、$$CH_3^{\;}CO{O^-}、$$C{O_3}^{2-}$ | |
| B. | 无色溶液中$M{g^{2+}}、Mn{O_4}^-、S{O_4}^{2-}、{I^-}$ | |
| C. | 酸性溶液中可能大量存在 $N{a^+}、Cl{O^-}、S{O_4}^{2-}、{I^-}$ | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中$N{H_4}^+、C{l^-}$、Al3+、$N{O_3}^-$ |
6.下列解释事实的化学用语,正确的是( )
| A. | 在空气中切开金属钠,光亮表面变暗:2Na+O2═Na2O2 | |
| B. | 向氯化铝溶液中加入过量氨水,产生白色沉淀:Al3++3OH-═Al(OH)3↓ | |
| C. | 将铁粉与水蒸气共热,产生气体:2Fe+3H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2 | |
| D. | 盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH═Na2SiO3+H2O |