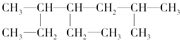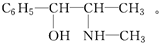题目内容
下列各组离子能在指定环境中大量共存的是( )
A、c(HCO
| ||||||
B、室温下,由水电离出的c(H+)=1×10-12 mol?L-1的溶液中:Fe2+、ClO-、Na+、SO
| ||||||
C、无色透明溶液中:SO
| ||||||
D、使红色石蕊试纸变蓝的溶液中:SO
|
考点:离子共存问题
专题:离子反应专题
分析:A.与HCO3-发生反应的离子不能大量共存;
B.由水电离出的c(H+)=1×10-12 mol?L-1的溶液,可能呈碱性或酸性;
C.有颜色的离子不能大量存在;
D.使红色石蕊试纸变蓝的溶液呈碱性.
B.由水电离出的c(H+)=1×10-12 mol?L-1的溶液,可能呈碱性或酸性;
C.有颜色的离子不能大量存在;
D.使红色石蕊试纸变蓝的溶液呈碱性.
解答:
解:A.Al3+与HCO3-发生互促水解反应而不能大量共存,故A错误;
B.由水电离出的c(H+)=1×10-12 mol?L-1的溶液,可能呈碱性或酸性,无论呈酸性还是碱性,Fe2+、ClO-都发生氧化还原反应而不能大量共存,故B错误;
C.Fe3+有颜色,不能大量存在,故C错误;
D.使红色石蕊试纸变蓝的溶液呈碱性,碱性条件下,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
B.由水电离出的c(H+)=1×10-12 mol?L-1的溶液,可能呈碱性或酸性,无论呈酸性还是碱性,Fe2+、ClO-都发生氧化还原反应而不能大量共存,故B错误;
C.Fe3+有颜色,不能大量存在,故C错误;
D.使红色石蕊试纸变蓝的溶液呈碱性,碱性条件下,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评:本题考查了离子共存,明确离子共存的条件是解本题关键,只要离子之间不生成沉淀、气体、弱电解质、不发生氧化还原反应、不生成络合物、不发生双水解反应等即可共存,注意有些习题有限制性条件,为易错点.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
能正确表示下列反应的离子方程式是( )
| A、NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O |
| B、碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+2OH-═CO32-+NH3?H2O+H2O |
| C、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| D、用惰性电极电解熔融氯化钠:2Cl-+2H2O═Cl2↑+H2↑+2OH- |
已知氧化还原反应可以看成是有化合价升降的反应,氧化剂得电子化合价降低,还原剂失电子化合价升高,还原剂把电子转移给氧化剂.在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+,MnO4-→Mn2+,Cl2→Cl-,HNO2→NO.如果分别用等量的这些物质氧化足量的KI,得到I2最多的是( )
| A、Fe3+ |
| B、MnO4- |
| C、Cl2 |
| D、HNO2 |
将4.6g Na和2.7gAl同时加入到足量的水中充分反应,下列说法正确的是( )
| A、所得溶液中阳离子和阴离子的物质的量之比为1:2 |
| B、反应中消耗的水的质量是加入的Al的质量的2倍 |
| C、所得溶液中Na+和Al3+的物质的量之比为2:1 |
| D、反应中放出的气体在标准状况下的体积为2.24L |
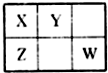 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若X原子的最外层电子数比其次外层电子数多3个,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若X原子的最外层电子数比其次外层电子数多3个,下列说法正确的是( )| A、Y位于第二周期第ⅣA族 |
| B、非金属性:Y>Z>X |
| C、原子半径:Z>Y>X |
| D、X、W的氢化物相遇会产生白烟 |
白磷会对人体造成严重的烧伤,白磷(P4)分子结构为 .下列说法不正确的是( )
.下列说法不正确的是( )
 .下列说法不正确的是( )
.下列说法不正确的是( )| A、白磷着火点低,在空气中可自燃 |
| B、白磷、红磷互为同素异形体 |
| C、31g白磷中,含P-P键1.5 mol |
| D、已知P4(白磷,s)+3O2(g)═2P2O3(s)△H=-Q kJ?mol-1,则白磷的燃烧热为Q kJ?mol-1 |
下列化学用语正确的是( )
| A、乙烯的分子式:CH2═CH2 |
| B、次氯酸分子的结构式:H-O-Cl |
C、羟基的电子式: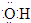 |
| D、以铁作阳极电解时,阳极的电极反应式:Fe-3e-═Fe3+ |