��Ŀ����
���³�ѹ�£���a mol CO2����ͨ��1L bmol/L��NaOH��Һ�У����ж�������Һ����������ȷ���ǣ�������
A�� ��a=2bʱ������CO2�����ͨ�룬��Һ����ˮ�������c��H+������ͼ�仯��ϵ | ||
| B����a=bʱ��������Һ�д��ڣ�c��OH-��+c��CO32-��=c��H+��+c��H2CO3�� | ||
| C����2a=bʱ��������Һ�д��ڣ�c��Na+����c��CO32-����c��OH-����c��HCO3-����c��H+�� | ||
D����
|
���㣺���ӷ���ʽ���йؼ���,����Ũ�ȴ�С�ıȽ�
ר�⣺
������A��n��CO2����n��NaOH��=2bmol��bmol=2��1�����Զ��߷�Ӧ����NaHCO3�������ķ�Ӧ����Ϊ2NaOH+CO2=Na2CO3+H2O��Na2CO3+CO2+H2O=2NaHCO3����������ˮ���룬���������ӵ��δٽ�ˮ���룬��CO32-ˮ��̶�ԶԶ����HCO3-��
B����a=bʱ������ǡ����ȫ��Ӧ����NaHCO3�����������غ���������
C����2a=bʱ������ǡ����ȫ��Ӧ���Na2CO3��Һ������Na2CO3����Һ�е���Ϊ��֪����Ũ�ȴ�С��ϵ��
D����
��
��1ʱ��������ҺΪNa2CO3��NaHCO3�Ļ����Һ�����������غ���������
B����a=bʱ������ǡ����ȫ��Ӧ����NaHCO3�����������غ���������
C����2a=bʱ������ǡ����ȫ��Ӧ���Na2CO3��Һ������Na2CO3����Һ�е���Ϊ��֪����Ũ�ȴ�С��ϵ��
D����
| 1 |
| 2 |
| a |
| b |
���
�⣺A��n��CO2����n��NaOH��=2bmol��bmol=2��1�����Զ��߷�Ӧ����NaHCO3�������ķ�Ӧ����Ϊ2NaOH+CO2=Na2CO3+H2O��Na2CO3+CO2+H2O=2NaHCO3����������ˮ���룬���������ӵ��δٽ�ˮ���룬��CO32-ˮ��̶�ԶԶ����HCO3-����Һ�е�������NaOHʱ������ˮ���룬��ת��ΪNa2CO3ʱ�ٽ�ˮ���룬��ת��ΪʱNaHCO3��Ҳ�ٽ�ˮ���룬���ٽ�ˮ����̶ȼ�С�����Է���ͼ��A��ȷ��
B����a=bʱ������ǡ����ȫ��Ӧ����NaHCO3������NaHCO3��Һ�е������غ��֪��c��OH-��+c��CO32-��=c��H+��+c��H2CO3������B��ȷ��
C����2a=bʱ������ǡ����ȫ��Ӧ���Na2CO3��Һ������Na2CO3����Һ�е���Ϊ��֪����Ũ�ȴ�С��ϵΪ��c��Na+����c��CO32-����c��OH-����c��HCO3-����c��H+������C��ȷ��
D����
��
��1ʱ��������ҺΪNa2CO3��NaHCO3�Ļ����Һ�����������غ��֪�ڴ���Һ��c��Na+����[c��CO32-��+c��HCO3-��+c��H2CO3��]�ı�ֵ����
��1֮�䣬������ȣ���D����
��ѡD��
B����a=bʱ������ǡ����ȫ��Ӧ����NaHCO3������NaHCO3��Һ�е������غ��֪��c��OH-��+c��CO32-��=c��H+��+c��H2CO3������B��ȷ��
C����2a=bʱ������ǡ����ȫ��Ӧ���Na2CO3��Һ������Na2CO3����Һ�е���Ϊ��֪����Ũ�ȴ�С��ϵΪ��c��Na+����c��CO32-����c��OH-����c��HCO3-����c��H+������C��ȷ��
D����
| 1 |
| 2 |
| a |
| b |
| 1 |
| 2 |
��ѡD��
���������⿼��������Һ������Ũ�ȴ�С�ȽϺ������غ㡢�����غ㣬�ۺ��Խ�ǿ�����ѶȲ���

��ϰ��ϵ�д�
�����Ŀ
ij������X������ˮ�������ռӦ������������ˮ�Ļ�����Y��������Y��Һ���������������������ɣ���X�ǣ�������
| A��SiO2 |
| B��Al2O3 |
| C��MgO |
| D��CuO |
ֻ���Թܺͽ�ͷ�ιܶ����������Լ������ֵ�һ���Լ��ǣ�������
| A��KOH��Һ��AlCl3��Һ |
| B��Na2CO3��Һ��HCl��Һ |
| C��MgCl2��Һ�Ͱ�ˮ |
| D�������NaAlO2��Һ |
��ͼ��ʾ��298Kʱ��N2��H2��Ӧ�����������仯������ͼ������������ȷ���ǣ�������

| A���÷�Ӧ���Ȼ�ѧ����ʽΪ��N2+3H2?2NH3 ��H=-92 kJ/mol |
| B��a�����Ǽ������ʱ�������仯���� |
| C������������û�ѧ��Ӧ�ķ�Ӧ�Ƚ������ı� |
| D�����¶ȡ����һ���������£�ͨ��1 mol N2��3 mol H2��Ӧ��ų�������ΪQ1 kJ����ͨ��2 mol N2��6 mol H2��Ӧ��ų�������ΪQ2 kJ����184��Q2��2Q1 |
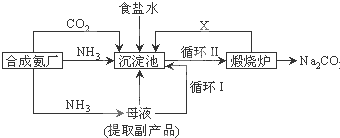
�й�����ε�˵��������ǣ�������
| A����ҵ�ϳ���ϡ��������� |
| B��ˮ���е�ˮ������ʳ��ˮ����ϴ |
| C��¯�������е��������ƾ���ǿ�ҵĸ�ʴ�� |
| D��̼�����׳ƴ�������ڲ�������ֽ��ϴ�Ӽ������� |
���������в���������ֱ�ӷ�Ӧ�Ƶõ��ǣ�������
| A��CuCl2 |
| B��Ca��ClO��2 |
| C��FeCl2 |
| D��NaCl |
��������װ0.1mol�����ƣ�����������С�ף�����ˮ�У���ȫ��Ӧ������ˮȡ�����ռ������壨��״���£�Ϊ��������
| A��H2��O2������� |
| B��1.12L H2 |
| C����1.12L H2 |
| D����1.12L H2 |
�������Ӽ��ܵ�������ˮ�⣬������ǿ���ǿ�Ӧ���ǣ�������
| A��CH3COO- |
| B��HSO4- |
| C��H2PO4- |
| D��AlO2- |