题目内容
碱金属及其化合物在工业生产和日常生活中都有广泛的用途
(1)反应Ⅰ:2Na+Na2O2
2Na2O 反应Ⅱ:10Na+2NaNO3
6Na2O+N2↑
①按照绿色化学的原则,最理想的原子经济就是反应物的原子全部转化为所期望的最终产物,上述两个反应中满足原子经济要求的是 (填序号)
②欲将23g钠全部转化成Na2O,现按照反应①进行反应,需将一部分钠氧化成Na2O2,则被氧化成Na2O2的金属钠的物质的量为
(2)金属锂是一种重要的储氢材料,吸氢和放氢原理如下
反应:Ⅰ.2Li+H2=2LiH;
反应:Ⅱ.LiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是,反应Ⅱ中的氧化剂是 .
(3)我国科学家候徳榜改革国外的纯碱生产工艺,生产流程如下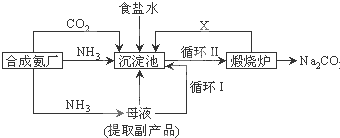
①沉淀池中发生的化学反应方程式是 .
②图中X的化学式为
母液中除通入NH3外,还应加入的物质为 .
(1)反应Ⅰ:2Na+Na2O2
| ||
| ||
①按照绿色化学的原则,最理想的原子经济就是反应物的原子全部转化为所期望的最终产物,上述两个反应中满足原子经济要求的是
②欲将23g钠全部转化成Na2O,现按照反应①进行反应,需将一部分钠氧化成Na2O2,则被氧化成Na2O2的金属钠的物质的量为
(2)金属锂是一种重要的储氢材料,吸氢和放氢原理如下
反应:Ⅰ.2Li+H2=2LiH;
反应:Ⅱ.LiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是,反应Ⅱ中的氧化剂是
(3)我国科学家候徳榜改革国外的纯碱生产工艺,生产流程如下

①沉淀池中发生的化学反应方程式是
②图中X的化学式为
母液中除通入NH3外,还应加入的物质为
考点:碱金属的性质,纯碱工业(侯氏制碱法),化学方程式的有关计算
专题:
分析:(1)①根据题中信息绿色化学的要求:反应物全部转化为期望的产物,使原子的利用率达到100%,可知为化合反应;
②根据2Na+Na2O2
2Na2O反应,欲将23g钠即1mol全部转化成Na2O,则需要0.5mol的过氧化钠,再根据钠守恒计算被氧化成Na2O2的金属钠的物质的量;
(2)根据化合价的变化判断;
(3)根据联合制碱法的原料为氨气、二氧化碳和饱和氯化钠,反应式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;主要的副产物为氯化铵,需要考虑氯化铵的回收利用,要提高原料的利用率,可以用循环使用的方法,据此分析解答.
②根据2Na+Na2O2
| ||
(2)根据化合价的变化判断;
(3)根据联合制碱法的原料为氨气、二氧化碳和饱和氯化钠,反应式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;主要的副产物为氯化铵,需要考虑氯化铵的回收利用,要提高原料的利用率,可以用循环使用的方法,据此分析解答.
解答:
解:(1)①由题中信息绿色化学的要求:反应物全部转化为期望的产物,使原子的利用率达到100%,可知为化合反应,故答案为:Ⅰ;
②因为2Na+Na2O2
2Na2O,欲将23g钠即1mol全部转化成Na2O,则需要0.5mol的过氧化钠,再根据钠守恒2Na~Na2O2,则被氧化成Na2O2的金属钠的物质的量为1mol,故答案为:1mol;
(2)2Li+H2
2LiH,该反应中锂失电子发生氧化反应,所以锂是还原剂;LiH+H2O=LiOH+H2↑,该反应中H2O得电子生成氢气,发生还原反应,所以H2O是氧化剂.
故答案为:Li;H2O;
(3)①沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,
反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,
故答案为:NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;
②在联合制碱法中二氧化碳是反应的原料同时也是反应的副产物,可以循环利用,
故答案为:CO2;
③向母液中通氨气,加入细小食盐颗粒,冷却析出副产品氯化铵,故答案为:细小食盐颗粒;
②因为2Na+Na2O2
| ||
(2)2Li+H2
| ||
故答案为:Li;H2O;
(3)①沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,
反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,
故答案为:NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;
②在联合制碱法中二氧化碳是反应的原料同时也是反应的副产物,可以循环利用,
故答案为:CO2;
③向母液中通氨气,加入细小食盐颗粒,冷却析出副产品氯化铵,故答案为:细小食盐颗粒;
点评:本题主要考察了方程式的计算、氧化还原反应基本概念的判断以及联合制碱法的原料、反应式以及副产物的回收利用,如何提高原料的利用率等,综合性强,难度不大.

练习册系列答案
相关题目
化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A、铝盐(明矾溶液)和铁盐(硫酸铁溶液)都有净水作用,两者的作用原理是相同的 |
| B、放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关 |
| C、0.1mol/L的CH3COONa溶液的pH约为9,说明CH3COOH是弱酸 |
| D、室温下向10mLpH=3的醋酸溶液中加入水稀释后,溶液中导电粒子的数目减少 |
欲使0.1mol?L-1NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少的方法是( )
| A、通入二氧化碳气体 |
| B、加入饱和石灰水 |
| C、通入HCl气体 |
| D、加入NaOH固体 |
镁粉是制备焰火的原料,工业上通过冷却镁蒸气制得镁粉.下列气体中可以用来冷却镁蒸气的是( )
| A、氢气 | B、二氧化碳 |
| C、氧气 | D、氩气 |
短周期主族元素W、X、Y、Z 的原子序数依次增大,XW4分子电子总数为10,Z最外层电子数是次外层的3倍.下列说法不正确的是( )
| A、W、X、Y、Z的原子半径大小顺序是X>Y>Z>W |
| B、元素Y的简单气态氢化物的热稳定性比X的强 |
| C、含上述四种元素的化合物一定易溶于水 |
| D、含上述四种元素的化合物可能既能与酸反应又能与碱反应 |
常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,下列对所得溶液的描述不正确的是( )
A、 当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H+)有如图变化关系 | ||
| B、当a=b时,所得溶液中存在:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) | ||
| C、当2a=b时,所得溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) | ||
D、当
|
有关Na2CO3和NaHCO3的性质,下列叙述中错误的是( )
| A、相同温度下,等浓度的Na2CO3和NaHCO3溶液的pH,Na2CO3更大 |
| B、常温时,Na2CO3的溶解度大于NaHCO3 |
| C、在酒精灯加热条件下,前者不分解,后者分解 |
| D、加入澄清石灰水,前者产生沉淀,后者不产生沉淀 |
下列有关物质的性质和该性质的应用均正确的是( )
| A、浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体 |
| B、二氧化硫具有漂白性,可用于加工食品使食品增白 |
| C、铝具有良好的导电性,钢抗拉强度大,钢芯铝绞线可用作远距离高压输电线材料 |
| D、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |



