题目内容
16.化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )| 选项 | 化学反应 | 测量依据(单位时间内) |
| A | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
| B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
| C | 2NO2?N2O4 | 颜色深浅 |
| D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.反应前后气体物质的量不变,压强始终不变;
B.单位时间内生成氢气的体积多少可以表明反应进行快慢;
C.NO2是红棕色气体,N2O4是无色气体,可以用单位时间内气体颜色的变化来衡量;
D.单位时间内沉淀质量的多少可以表示反应快慢.
解答 解:化学反应速率用单位时间内反应物的浓度的减少或生成物浓度的增加量来表示,
A.该反应是体积不变的反应,反应前后压强始终不变,故A不可行;
B.单位时间内H2体积变化多,速率快,故B可行;
C.2NO2?N2O4,NO2是红棕色气体,N2O4是无色气体,可以用单位时间内气体颜色的变化来衡量反应的快慢,故C可行;
D.单位时间内产生的沉淀的质量越高,速率越快,故D可行;
故选A.
点评 本题考查了化学反应速率的表示方法,单位时间内量的变化可以表示反应快慢,题目难度不大.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
6.25℃时,向盛有50mLpH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )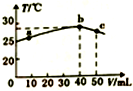

| A. | 25℃时,HA的电离平衡常数Ka约为1.43×10-3 | |
| B. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| C. | b→c的过程中,温度降低的主要原因是溶液中发生了吸热反应 | |
| D. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>c(H+) |
7.92235U是重要的核工业原料,下列有关92235U说法正确的是( )
| A. | 92235U原子核中含有92个中子 | B. | 92235U子核外有143个电子 | ||
| C. | 92235U与92238U互为同位素 | D. | 92235U与92238U互为同素异形体 |
1.下列离子方程式中书写正确的是( )
| A. | 碳酸氢铵溶液与足量的氢氧化钠溶液反应:NH4++OH-=NH3•H2O | |
| B. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 铜和稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| D. | 氯化铝溶液显酸性:Al3++3H2O?Al(OH)3↓+3H + |
8.0.1 mol.L-1KHS溶液中下列表达式不正确的是( )
| A. | c(K+)+c(H+)=c(OH-)+c(HS-)+2 c(S2-) | B. | c(K+)>c(S2-)>c(HS-)>c(OH-)>c(H+) | ||
| C. | c(HS-)+c(S2-)+c(H2S)=0.1 mol•L-1 | D. | c(S2-)+c(OH-)=c(H+)+c(H2S) |
6.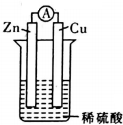 在用Zn片、Cu片和稀硫酸组成的电池装置中,下列说法中正确的是( )
在用Zn片、Cu片和稀硫酸组成的电池装置中,下列说法中正确的是( )
 在用Zn片、Cu片和稀硫酸组成的电池装置中,下列说法中正确的是( )
在用Zn片、Cu片和稀硫酸组成的电池装置中,下列说法中正确的是( )| A. | 锌片是正极,铜片上有气泡产生 | |
| B. | 电流方向是从锌片流向铜片 | |
| C. | 溶液中的阳离子向正极移动,阴离子向负极移动 | |
| D. | 经过一段时问工作后'电解液的pH值减小 |
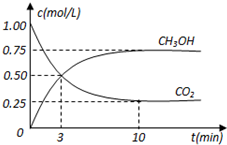 在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示.
在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示.