题目内容
13.下列反应既是离子反应,又是氧化还原反应的是( )| A. | Zn 粒与稀硫酸反应制取氢气 | |
| B. | 二氧化碳与氢氧化钠溶液反应生成碳酸钠 | |
| C. | 氧化铁在高温下与一氧化碳反应 | |
| D. | 碳酸钠溶液与石灰乳混合 |
分析 离子反应,应能在溶液中进行,且有离子参加反应,氧化还原反应的特征是有化合价的升降,以此解答该题.
解答 解:A.锌粒放入稀硫酸中,反应的实质是Zn+2H+=H2+Zn2+,既是离子反应又是氧化还原反应,故A正确;
B.该反应的实质是CO2+Ca2++2OH-=CaCO3↓+H2O,该反应中各元素的化合价都不变,所以不是氧化还原反应,但是离子反应,故B错误;
C.氧化铁在高温下与一氧化碳反应,没有离子参加,不是离子反应,元素的化合价发生变化,是氧化还原反应,故C错误;
D.碳酸钠溶液与石灰乳混合,反应中各元素的化合价都不变,所以不是氧化还原反应,但是离子反应,故D错误;
故选A.
点评 本题考查氧化还原反应、离子反应,题目难度不大,注意把握离子反应以及氧化还原反应的实质,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
4.下列物质中,既能发生水解反应,又能发生加成反应,但不能发生消去反应的是( )
| A. | CH2=CH-CH2CH2Cl | B. | (CH3)3CCH2OH | C. | CH3CHClCHO | D. | CH2=CHCH2COOCH3 |
1.液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)燃料的电池装置如图装置①该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列叙述不正确的是( )

| A. | 该燃料电池负极发生的电极反应为:N2H4+4OH--4e-═N2+4H2O | |
| B. | 用该燃料电池作为装置②的直流电源,产生1molCl2至少需要通入0.5molN2H4 | |
| C. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 | |
| D. | 该燃料电池中,电子从右侧电极经过外电路流向左侧电极,溶液中OH-则迁移到左侧 |
8.下列判断正确的是( )
①阴离子都只有还原性
②NO2溶于水时发生氧化还原反应
③1mol Cl2参加反应转移电子数一定为2NA
④BaSO3和H2O2的反应为氧化还原反应.
①阴离子都只有还原性
②NO2溶于水时发生氧化还原反应
③1mol Cl2参加反应转移电子数一定为2NA
④BaSO3和H2O2的反应为氧化还原反应.
| A. | ②④ | B. | ②③ | C. | ③④ | D. | ①④ |
18.甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整.向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
回答下列问题:
(1)反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H=-41.2kJ/mol.
(2)在初始阶段,甲烷蒸汽重整的反应速率小于甲烷氧化的反应速率(填大于、小于或等于).
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应CH4(g)+H2O(g)?CO(g)+3H2(g)KP的表达式为$\frac{{p}^{3}({H}_{2})p(CO)}{p(C{H}_{4})p({H}_{2}O)}$;随着温度的升高,该平衡常数增大(填“增大”、“减小”或“不变”).
(4)从能量角度分析,甲烷自热重整方法的先进之处在于系统内强放热的甲烷氧化反应为强吸热的蒸汽重整反应提供了所需的能量.
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如图1、2:
①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是B.
A.600℃,0.9Mpa B.700℃,0.9MPa C.800℃,1.5MpaD.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图3:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是甲烷氧化程度过高,导致生成的氢气和氧气反应.

| 反应 过程 | 化学方程式 | 焓变△H (kJ/mol) | 正反应活化能Ea (kJ/mol) |
| 甲烷 氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽 重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
(1)反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H=-41.2kJ/mol.
(2)在初始阶段,甲烷蒸汽重整的反应速率小于甲烷氧化的反应速率(填大于、小于或等于).
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应CH4(g)+H2O(g)?CO(g)+3H2(g)KP的表达式为$\frac{{p}^{3}({H}_{2})p(CO)}{p(C{H}_{4})p({H}_{2}O)}$;随着温度的升高,该平衡常数增大(填“增大”、“减小”或“不变”).
(4)从能量角度分析,甲烷自热重整方法的先进之处在于系统内强放热的甲烷氧化反应为强吸热的蒸汽重整反应提供了所需的能量.
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如图1、2:
①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是B.
A.600℃,0.9Mpa B.700℃,0.9MPa C.800℃,1.5MpaD.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图3:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是甲烷氧化程度过高,导致生成的氢气和氧气反应.

8.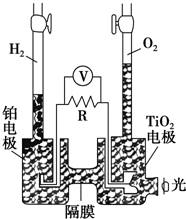 TiO2在光照射下可使水分解:2H2O $\frac{\underline{\;TiO_{2}\;}}{\;}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O $\frac{\underline{\;TiO_{2}\;}}{\;}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
 TiO2在光照射下可使水分解:2H2O $\frac{\underline{\;TiO_{2}\;}}{\;}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O $\frac{\underline{\;TiO_{2}\;}}{\;}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | 该装置可以将光能转化为电能,同时也能将其转化为化学能 | |
| B. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变大 |
9.某元素R的最高价氧化物的水化物是HnRO2n-2,则在气态氢化物中R元素的化合价是( )
| A. | -10+3n | B. | -6+3n | C. | -(12-3n) | D. | -(4-2n) |
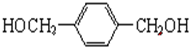 .
.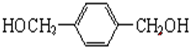 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$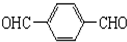 +2H2O.
+2H2O. .(原子量:Ag--108)
.(原子量:Ag--108)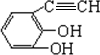 (只写出一种即可).
(只写出一种即可).