题目内容
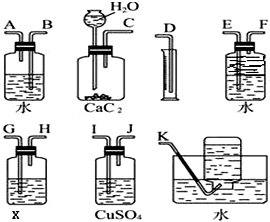 实验室用电石和水反应制备乙炔,其中含有杂质,为了净化和检验乙炔气体,并通过测定气体体积计算电石纯度,按下列要求填空(X为含溴3.2%的四氯化碳溶液150g)
实验室用电石和水反应制备乙炔,其中含有杂质,为了净化和检验乙炔气体,并通过测定气体体积计算电石纯度,按下列要求填空(X为含溴3.2%的四氯化碳溶液150g)(1)选用几种必要装置连接,装置接口的连接顺序为
(2)写出制取乙炔的化学方程式:
(3)为了得到平稳的气流,用
(4)CuSO4溶液的作用是
发生反应的离子方程式为
(5)假设溴水与乙炔恰好完全反应生成C2H2Br4,用Wg的电石与水反应,测得排入量筒内液体体积为VmL,(标况),此电石的纯度计算式为
考点:探究物质的组成或测量物质的含量
专题:实验题
分析:(1)气体制备装置、净化装置(除硫化氢)、检验装置、排水测体积的装置;
(2)碳化钙与水反应生成氢氧化钙和乙炔;
(3)碳化钙与水反应很剧烈,用饱和食盐水可以减缓反应;
(4)生成的乙炔中含有杂质硫化氢;硫酸铜与硫化氢生成硫酸和硫化铜;
(5)根据溴单质的物质的量求出消耗的乙炔的量,再根据水的体积求出乙炔的体积,然后根据乙炔求出碳化钙的量,再求质量分数.
(2)碳化钙与水反应生成氢氧化钙和乙炔;
(3)碳化钙与水反应很剧烈,用饱和食盐水可以减缓反应;
(4)生成的乙炔中含有杂质硫化氢;硫酸铜与硫化氢生成硫酸和硫化铜;
(5)根据溴单质的物质的量求出消耗的乙炔的量,再根据水的体积求出乙炔的体积,然后根据乙炔求出碳化钙的量,再求质量分数.
解答:
解:(1)实验室用电石和水反应制备乙炔,其中含有杂质,为了净化和检验乙炔气体,并通过测定气体体积计算电石纯度,则需要的装备依次为:气体制备装置、净化装置(除硫化氢)、检验装置、排水测体积的装置,则装置接口的连接顺序为C I J G H F E D;
故答案为:C I J G H F E D;
(2)碳化钙与水反应生成氢氧化钙和乙炔,其反应的化学方程为:CaC2+2H2O→Ca(OH)2+C2H2↑;
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(3)碳化钙与水反应很剧烈,用饱和食盐水可以减缓反应,所以为了得到平稳的气流,用饱和食盐水代替水;故答案为:饱和食盐水;
(4)生成的乙炔中含有杂质硫化氢,用硫酸铜溶液可以吸收硫化氢;硫酸铜与硫化氢生成硫酸和硫化铜,其反应的离子方程式为:H2S+Cu2+=CuS↓+2H+;
故答案为:除去H2S气体;H2S+Cu2+=CuS↓+2H+;
(5)溴水与乙炔恰好完全反应生成C2H2Br4,溴单质的物质的量为:
=0.03mol,则消耗的乙炔为0.015mol,
测得排入量筒内液体体积为VmL(标况),则乙炔的体积为Vml,其物质的量为
=
mol,
所以乙炔的总物质的量为0.015+
mol,由CaC2+2H2O-→Ca(OH)2+C2H2↑可知CaC2为0.015+
mol,
所以电石的纯度为
×100%;
故答案为:
×100%.
故答案为:C I J G H F E D;
(2)碳化钙与水反应生成氢氧化钙和乙炔,其反应的化学方程为:CaC2+2H2O→Ca(OH)2+C2H2↑;
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(3)碳化钙与水反应很剧烈,用饱和食盐水可以减缓反应,所以为了得到平稳的气流,用饱和食盐水代替水;故答案为:饱和食盐水;
(4)生成的乙炔中含有杂质硫化氢,用硫酸铜溶液可以吸收硫化氢;硫酸铜与硫化氢生成硫酸和硫化铜,其反应的离子方程式为:H2S+Cu2+=CuS↓+2H+;
故答案为:除去H2S气体;H2S+Cu2+=CuS↓+2H+;
(5)溴水与乙炔恰好完全反应生成C2H2Br4,溴单质的物质的量为:
| 150g×3.2% |
| 160g/mol |
测得排入量筒内液体体积为VmL(标况),则乙炔的体积为Vml,其物质的量为
| V×10-3L |
| 22.4L/mol |
| V |
| 22400 |
所以乙炔的总物质的量为0.015+
| V |
| 22400 |
| V |
| 22400 |
所以电石的纯度为
(0.015+
| ||
| W |
故答案为:
(0.015+
| ||
| W |
点评:本题考查了物质性质的探究实验分析判断,实验数据的分析和计算,乙炔性质和制备,掌握实验基本操作和实验设计方法是解题关键,题目难度中等.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
下列有关实验的说法正确的是( )
| A、除去铁粉中的铜粉,加入足量浓硫酸加热反应后进行过滤 |
| B、不用任何其他试剂就可以鉴别NaOH溶液和Al2(SO4)3溶液 |
| C、制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中 |
| D、某溶液加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液一定含有大量CO32- |
下列纯净物不能和金属钠反应的是( )
| A、苯酚 | B、甘油 | C、酒精 | D、苯 |
现加热5.00g NaHCO3和Na2CO3的混合物,使NaHCO3完全分解,产生标况下CO2气体体积为224ml,则原混合物中Na2CO3的质量为( )
| A、3.32g |
| B、4.16g |
| C、4.58g |
| D、4.41g |
 有机物X、A、B、C有如图转化关系:
有机物X、A、B、C有如图转化关系: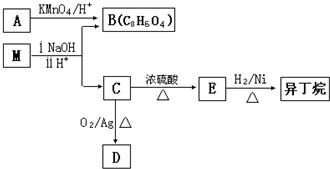
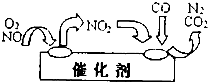 直接排放含二氧化硫、氮氧化物均会危害环境,必须对它们进行处理.
直接排放含二氧化硫、氮氧化物均会危害环境,必须对它们进行处理. 的方法是
的方法是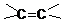 应先检验哪一个官能团?
应先检验哪一个官能团?