题目内容
X、Y、Z、W是短周期的四种元素,有关他们的信息如下表所示.
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)X的气态氢化物分子的电子式是 ,Z元素在周期表中的位置是 .
(2)X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是 .
(3)常温时,W的硫酸盐溶液的pH 7(填“=”、“>”或“<”),理由是: (用离子方程式表示).
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示) .
(5)25℃、101kPa时,32g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6kJ的热量,写出该反应的热化学方程式 .
| 元素 | 部分结构知识 | 部分性质 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
(1)X的气态氢化物分子的电子式是
(2)X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是
(3)常温时,W的硫酸盐溶液的pH
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示)
(5)25℃、101kPa时,32g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6kJ的热量,写出该反应的热化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W是短周期的四种元素,X的单质由双原子分子构成,分子中有14个电子,X有多种氧化物,如XO、XO2、X2O4等,通常情况下XO2与X2O4共存,故X为N元素;
Y原子的次外层电子数等于最外层电子数的一半,Y有2个电子层,最外层电子数为4,Y能形成多种气态氢化物,则Y为C元素;
Z原子的最外层电子数多于4,Z元素的最高正化合价与最低负化合价代数和等于6,则Z最外层有7个电子,故Z为Cl元素;
W原子的最外层电子数等于2n-3(n为原子核外电子层数),化学反应中W原子易失去最外层电子形成Wn+,则2n-3=n,解得n=3,则W为Al元素.
Y原子的次外层电子数等于最外层电子数的一半,Y有2个电子层,最外层电子数为4,Y能形成多种气态氢化物,则Y为C元素;
Z原子的最外层电子数多于4,Z元素的最高正化合价与最低负化合价代数和等于6,则Z最外层有7个电子,故Z为Cl元素;
W原子的最外层电子数等于2n-3(n为原子核外电子层数),化学反应中W原子易失去最外层电子形成Wn+,则2n-3=n,解得n=3,则W为Al元素.
解答:
解:X、Y、Z、W是短周期的四种元素:X的单质由双原子分子构成,分子中有14个电子,X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存,故X为氮元素;Y原子的次外层电子数等于最外层电子数的一半,Y有2个电子层,最外层电子数为4,Y能形成多种气态氢化物,则Y为碳元素;Z原子的最外层电子数多于4,Z元素的最高正化合价与最低负化合价代数和等于6,则Z最外层有7个电子,故Z为氯元素;W原子的最外层电子数等于2n-3(n为原子核外电子层数),化学反应中W原子易失去最外层电子形成Wn+,则2n-3=n,解得n=3,则W为铝元素,所以:X为氮元素、Y为碳元素、Z为氯元素、W为铝元素,
(1)X为氮元素,X的气态氢化物为NH3,氮原子与氢原子之间形成1对共用电子对,电子式为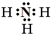 ;Z为Cl元素,有3个电子层,最外层有7个电子,在周期表中位于第三周期第ⅦA族,
;Z为Cl元素,有3个电子层,最外层有7个电子,在周期表中位于第三周期第ⅦA族,
故答案为: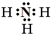 ;第三周期第ⅦA族;
;第三周期第ⅦA族;
(2)X为氮元素、Y为碳元素、Z为氯元素,非金属性越强,最高价氧化物的水化物酸性越强,非金属性Cl>N>C,所以酸性HClO4>HNO3>H2CO3,
故答案为:HClO4>HNO3>H2CO3;
(3)W的硫酸盐为硫酸铝,硫酸铝是强酸弱碱盐,常温时,铝离子水解 Al3++3H2O Al(OH)3+3H+,溶液的pH<7,
Al(OH)3+3H+,溶液的pH<7,
故答案为:<; Al3++3H2O Al(OH)3+3H+;
Al(OH)3+3H+;
(4)X的氢化物为NH3,W的氢氧化物为Al(OH)3,用氨水制取Al(OH)3的离子方程式为Al3++3NH3?H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3?H2O═Al(OH)3↓+3NH4+;
(5)25℃、101kPa时,32gCH4的物质的量为2mol,完全燃烧生成稳定的氧化物时放出1780.6kJ的热量,1mol甲烷完全燃烧生成稳定的氧化物时放出890.3kJ的热量,该反应的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol.
(1)X为氮元素,X的气态氢化物为NH3,氮原子与氢原子之间形成1对共用电子对,电子式为
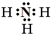 ;Z为Cl元素,有3个电子层,最外层有7个电子,在周期表中位于第三周期第ⅦA族,
;Z为Cl元素,有3个电子层,最外层有7个电子,在周期表中位于第三周期第ⅦA族,故答案为:
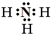 ;第三周期第ⅦA族;
;第三周期第ⅦA族;(2)X为氮元素、Y为碳元素、Z为氯元素,非金属性越强,最高价氧化物的水化物酸性越强,非金属性Cl>N>C,所以酸性HClO4>HNO3>H2CO3,
故答案为:HClO4>HNO3>H2CO3;
(3)W的硫酸盐为硫酸铝,硫酸铝是强酸弱碱盐,常温时,铝离子水解 Al3++3H2O
 Al(OH)3+3H+,溶液的pH<7,
Al(OH)3+3H+,溶液的pH<7,故答案为:<; Al3++3H2O
 Al(OH)3+3H+;
Al(OH)3+3H+;(4)X的氢化物为NH3,W的氢氧化物为Al(OH)3,用氨水制取Al(OH)3的离子方程式为Al3++3NH3?H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3?H2O═Al(OH)3↓+3NH4+;
(5)25℃、101kPa时,32gCH4的物质的量为2mol,完全燃烧生成稳定的氧化物时放出1780.6kJ的热量,1mol甲烷完全燃烧生成稳定的氧化物时放出890.3kJ的热量,该反应的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol.
点评:本题以元素推断为载体,考查电子式与热化学反应方程式等化学用语、盐类水解、元素周期律、元素化合物性质等,综合性较大,难度中等,是对所学知识的综合性考查,注意基础知识的理解掌握.推断元素是解题关键.

练习册系列答案
相关题目
某饱和一元醛在与银氨溶液反应时,能够生成21.6g银,再将等量的醛完全燃烧生成二氧化碳13.44L(标准状况下),则该醛是( )
| A、丙醛 | B、丁醛 |
| C、3-甲基丁醛 | D、己醛 |
 已知有机物A、B、C、D、E、F之间的转化关系如图所示.D是常用做汽车发动机的抗冻剂,E为聚合物,F是一种烃,其相对分子量为26.根据信息回答下列问题.
已知有机物A、B、C、D、E、F之间的转化关系如图所示.D是常用做汽车发动机的抗冻剂,E为聚合物,F是一种烃,其相对分子量为26.根据信息回答下列问题.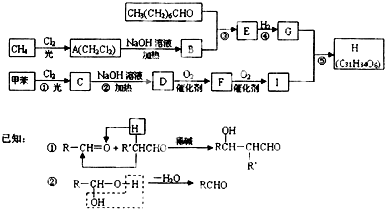
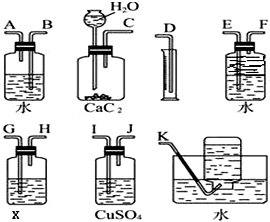 实验室用电石和水反应制备乙炔,其中含有杂质,为了净化和检验乙炔气体,并通过测定气体体积计算电石纯度,按下列要求填空(X为含溴3.2%的四氯化碳溶液150g)
实验室用电石和水反应制备乙炔,其中含有杂质,为了净化和检验乙炔气体,并通过测定气体体积计算电石纯度,按下列要求填空(X为含溴3.2%的四氯化碳溶液150g)