题目内容
14.在两种短周期元素组成的化合物中,它们的原子个数比为1:2,设两种元素的原子序数分别为a和b,则下列对a和b可能的关系概括得最完全的是 ①a+b=15 ②a=b+6 ③a=b-5 ④a+b=22( )| A. | ①④ | B. | ①③④ | C. | ①②③④ | D. | ①②④ |
分析 两种短周期元素组成的化合物中原子数比为1:2,则化学式为AB2型,可能为第ⅡA族与ⅤⅡA组元素组成、可能为第ⅣA族和ⅥA族元素组成、还可能为NO2、SO2,注意C2H4中原子数比为1:2,然后分析原子序数的关系.
解答 解:两种短周期元素组成的化合物中原子数比为1:2,则化学式为AB2型,
两种元素的原子序数分别是a和b,
①若为NO2,则7+8=15,故①可能;
②若为SiO2,则14=8+6,故②可能;
③若为MgCl2,则17-5=12,故③可能;
④若为CO2,则6+16=22,故④可能;
显然①②③④都可能,
故选C.
点评 本题考查化合物中原子序数的关系,为高频考点,侧重于学生的分析能力的考查,明确常见的AB3型的化合物是解答本题的关键,题目难度较大.

练习册系列答案
相关题目
19.短周期主族元素X、Y、Z、W的原子序数依次递增,X的一种原子核内无中子,Y原子最外层电子数是内层电子总数的2倍,W原子最外层电子数是Y原子最外层电子数的1.5倍,Z、W同主族,下列说法正确的是( )
| A. | 含X与Y的化合物只有2种 | |
| B. | Y、W的氧化物均为酸性氧化物 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X与Z形成的化合物中,各原子均满足8电子稳定结构 |
9.下列各组有机物的鉴别(括号内为鉴别试剂)不合理的是( )
| A. | 苯、甲苯、溴乙烷(酸性高锰酸钾溶液) | B. | 乙醇、乙醛、乙酸(新制Cu(OH)2 | ||
| C. | 苯、乙醇、四氯化碳(水) | D. | 苯、己烷、苯酚溶液(浓溴水) |
19.某溶液中有NH4+、Mg2+、Fe2+和Fe3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中下列阳离子的物质的量基本不变的是( )
| A. | NH4+ | B. | Mg2+ | C. | Fe2+ | D. | Fe3+ |
6.下列各组顺序的排列不正确的是( )
| A. | 熔点:Li>Na>K | B. | 还原性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 原子半径:Na<Mg<Al |
3.对于某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入KSCN溶液,若溶液变成血红色,则一定有Fe3+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
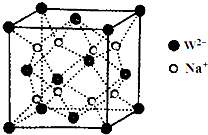 前四周期元素X、Y、Z、W、R、Q的原子序数依次增大,X的核外电子总数与其周期数相同;Y有三个能级,且每个能级上的电子数相等;Z原子单电子数在同周期元素中最多;W与Z同周期,第一电离能比Z的低;R与Y同一主族,Q的最外层电子数为2,其他电子层电子均处于饱和状态.请回答下列问题:
前四周期元素X、Y、Z、W、R、Q的原子序数依次增大,X的核外电子总数与其周期数相同;Y有三个能级,且每个能级上的电子数相等;Z原子单电子数在同周期元素中最多;W与Z同周期,第一电离能比Z的低;R与Y同一主族,Q的最外层电子数为2,其他电子层电子均处于饱和状态.请回答下列问题: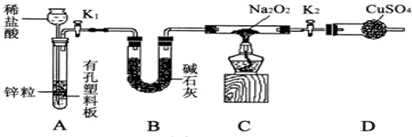 钠的化合物在工农业生产和人们的日常生活中有着广泛的应用,其中Na2O2常用作漂白剂和潜水艇中的供氧剂.Na2O2有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能反应.为了验证此推测结果,该同学设计并进行如下实验,实验步骤和现象如下.
钠的化合物在工农业生产和人们的日常生活中有着广泛的应用,其中Na2O2常用作漂白剂和潜水艇中的供氧剂.Na2O2有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能反应.为了验证此推测结果,该同学设计并进行如下实验,实验步骤和现象如下.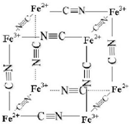 铁及其化合物在生产生活及科学研究方面应用非常广泛.
铁及其化合物在生产生活及科学研究方面应用非常广泛. ,其空间构型为直线型.
,其空间构型为直线型.