题目内容
19.某溶液中有NH4+、Mg2+、Fe2+和Fe3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中下列阳离子的物质的量基本不变的是( )| A. | NH4+ | B. | Mg2+ | C. | Fe2+ | D. | Fe3+ |
分析 加入过量的氢氧化钠溶液,微热后NH4+转化为气体,Mg2+、Fe2+、Fe3+结合生成沉淀,氢氧化亚铁被氧化为氢氧化铁后与盐酸反应,铁离子增多,亚铁离子减少,以此来解答.
解答 解:加入过量的氢氧化钠溶液,微热后NH4+转化为气体,Mg2+、Fe2+、Fe3+结合生成沉淀,
氢氧化镁与盐酸反应生成镁离子,数目不变,而氢氧化亚铁被氧化为氢氧化铁后与盐酸反应,铁离子增多,亚铁离子减少,
综上所述,Mg2+和数目不发生变化,
故选B.
点评 本题考查离子的共存问题,为高考常见的题型,侧重复分解反应的考查,把握离子的性质及氢氧化铝的两性,亚铁易被氧化等为解答的关键,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
7.二氧化碳和钠在一定条件下反应可制得金刚石,其化学方程式为3CO2+4Na=2X+C(金刚石).下列有关此反应的叙述中,不正确的是( )
| A. | Na通常保存在煤油中,而同族的Li只能保存在液体石蜡中 | |
| B. | 金刚石与石墨互为同素异形体,已知 燃烧热金刚石更高,则石墨比金刚石更稳定 | |
| C. | X的化学式为Na2CO3,若Mg 与CO2则生成MgO和C | |
| D. | 当有0.4molNa参与反应时,被氧化的CO2为0.3NA |
14.在两种短周期元素组成的化合物中,它们的原子个数比为1:2,设两种元素的原子序数分别为a和b,则下列对a和b可能的关系概括得最完全的是 ①a+b=15 ②a=b+6 ③a=b-5 ④a+b=22( )
| A. | ①④ | B. | ①③④ | C. | ①②③④ | D. | ①②④ |
4.下列叙述不正确的是( )
| A. | 在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 | |
| B. | 铁管上镶嵌锌块,铁管不易被腐蚀 | |
| C. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| D. | 将海水中的钢铁闸门与电源的负极相连,可防止闸门被腐蚀 |
8. 在一定温度下,1L的密闭容器内某一反应M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,1L的密闭容器内某一反应M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )
 在一定温度下,1L的密闭容器内某一反应M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,1L的密闭容器内某一反应M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )| A. | t1时,N的浓度是M的浓度的2倍 | |
| B. | t2时,正逆反应速率相等,反应达到平衡 | |
| C. | t3时,正反应速率大于逆反应速率 | |
| D. | 反应的化学方程式为:M?2N |
9.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置.某微生物燃料电池的工作原理如下图所示,下列说法正确的是( )


| A. | b是电池的负极 | |
| B. | HS-在硫氧化菌作用下转化为SO42-的反应是:HS-+4H2O-8e-═SO42-+9H+ | |
| C. | 该电池在高温下进行效率更高 | |
| D. | 若该电池有0.4 mol 电子转移,则有0.45 mol H+通过质子交换膜 |
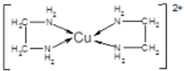
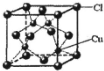 ,其中Cl-的配位数为4,已知晶胞的棱长为dcm,用NA表示阿伏加德罗常数值,则晶胞的密度表达式为$\frac{396}{{d}^{3}•{N}_{A}}$g/cm3.
,其中Cl-的配位数为4,已知晶胞的棱长为dcm,用NA表示阿伏加德罗常数值,则晶胞的密度表达式为$\frac{396}{{d}^{3}•{N}_{A}}$g/cm3.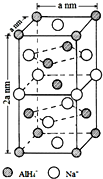
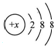 其中:
其中: