题目内容
下列叙述中正确的是( )
| A、NH3、CO、CO2都是极性分子 |
| B、CH4、CO2都是含有极性键的非极性分子 |
| C、HF、HCl、HBr的沸点依次增强 |
| D、CS2、H2O、C2H2都是直线型分子 |
考点:极性分子和非极性分子,判断简单分子或离子的构型
专题:化学键与晶体结构
分析:A、分子结构不对称,正负电荷的中心不重合的分子为极性分子;
B、结构对称且正负电荷的中心重合的分子为非极性分子;
C、同主族元素的氢化物相对分子质量越大,沸点越高,含有氢键的反常;
D、根据分子的结构分析.
B、结构对称且正负电荷的中心重合的分子为非极性分子;
C、同主族元素的氢化物相对分子质量越大,沸点越高,含有氢键的反常;
D、根据分子的结构分析.
解答:
解:A、NH3为三角锥形,CO为直线形,二者分子结构不对称属于极性分子,CO2分子结构对称且正负电荷的中心重合属于非极性分子,故A错误;
B、CH4是正四面体,CO2为直线形,分子结构对称且正负电荷的中心重合的分子为非极性分子,故B正确;
C、同主族元素的氢化物相对分子质量越大,沸点越高,HF含有氢键的沸点反常,所以HCl、HBr、HF的沸点依次增强,故C错误;
D、CS2的结构为S=C=S,C2H2的结构为H-C≡C-H,二者均为直线形分子,H2O分子的结构为V形,故D错误.
故选B.
B、CH4是正四面体,CO2为直线形,分子结构对称且正负电荷的中心重合的分子为非极性分子,故B正确;
C、同主族元素的氢化物相对分子质量越大,沸点越高,HF含有氢键的沸点反常,所以HCl、HBr、HF的沸点依次增强,故C错误;
D、CS2的结构为S=C=S,C2H2的结构为H-C≡C-H,二者均为直线形分子,H2O分子的结构为V形,故D错误.
故选B.
点评:本题考查了分子极性的判断、分子空间构型的判断,把握非极性分子和极性分子的判断方法是关键,题目难度不大.

练习册系列答案
相关题目
下列关于电解质溶液的叙述正确的是( )
| A、常温下,由0.1mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在:BOH?B++OH- |
| B、常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C、中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D、将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
下列物质中属于碱性氧化物的是( )
| A、O2 |
| B、Na2O |
| C、NaClO |
| D、SO2 |
下列说法正确的是( )
| A、NaOH溶于水共价键被破坏 |
| B、稀有气体的原子间存在共价键 |
| C、二氧化碳分子的结构式:O═C═O |
| D、MgF2、H2O2含有的化学键类型相同 |
下列反应的离子方程式正确的是( )
| A、稀硫酸与氢氧化钡溶液反应:SO42-+2H++2OH-+Ba2+═BaSO4↓+2H2O |
| B、饱和FeCl3溶液滴入沸水中制备氢氧化铁胶体:Fe3++3H2O=Fe(OH)3↓+3H+ |
| C、氧化铜与稀硫酸反应:2H++O2-═H2O |
| D、澄清石灰水与氯化铜溶液反应:Cu2++Ca(OH)2═Cu(OH)2↓+Ca2+ |
 含一个碳碳三键的炔烃加氢后的结构简式为该炔烃可能的结构有( )
含一个碳碳三键的炔烃加氢后的结构简式为该炔烃可能的结构有( )| A、2种 | B、3种 | C、4种 | D、5种 |
下列说法正确的是( )
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B、100℃时,pH=2的盐酸和pH=12的NaOH溶液等体积混合后,溶液为碱性 |
| C、pH=a的醋酸溶液加水稀释十倍后,溶液pH=a+1 |
| D、25℃时,用浓度均为0.1000mol/L的醋酸和盐酸溶液滴定等浓度NaOH溶液,二者pH突变范围相同 |
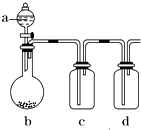 有几个实验小组的同学,利用右图装置进行“一器多用”的实验探究(a中盛放的液体均匀慢速滴下;b中盛放的药品足量;若在c、d中盛装液体,则长导管均浸入液面以下),每组同学设想在a、b、c、d中分别盛放不同物质,来制取某种气体并检验其性质.
有几个实验小组的同学,利用右图装置进行“一器多用”的实验探究(a中盛放的液体均匀慢速滴下;b中盛放的药品足量;若在c、d中盛装液体,则长导管均浸入液面以下),每组同学设想在a、b、c、d中分别盛放不同物质,来制取某种气体并检验其性质.