题目内容
5.(1)燃料电池已广泛应用于航空领域.如图是一种新型燃料电池装置,其总反应方程式为N2H4+O2=N2+2H2O,通入N2H4(肼)的一极是电池的负极(填“正极”或“负极”),该电极的电极反应式为N2H4+4OH--4e-=N2+4H2O.放电过程中,溶液中的阳离子移向正极(填“正极”或“负极”).(2)在上述燃料电池中,若完全消耗16gN2H4,则理论上外电路中转移电子的物质的量为2mol,消耗氧气的体积为11.2L(标准状况).
(3)与传统火力发电相比,燃料电池的优点是能量转化率高、排出物不污染环境.
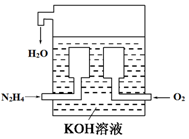
分析 (1)在肼(N2H4)燃料电池中,通入燃料气体N2H4为负极失电子发生氧化反应,阳离子移向正极;
(2)根据负极N2H4失电子发生的氧化反应及总反应计算;
(3)燃料电池的优点是能量转化率高并且排出物不污染环境.
解答 解:(1)在肼(N2H4)燃料电池中,通入燃料气体N2H4为负极失电子发生氧化反应,反应式为:N2H4+4OH--4e-=N2+4H2O,放电过程中,溶液中的阳离子移向正极,故答案为:负极;N2H4+4OH--4e-=N2+4H2O;正极;
(2)由负极反应式N2H4+4OH--4e-=N2+4H2O,则完全消耗16gN2H4,理论上外电路中转移电子的物质的量为$\frac{16g}{32g/mol}$×4=2mol,又总反应方程式为N2H4+O2=N2+2H2O,所以消耗氧气的体积为$\frac{16g}{32g/mol}$×22.4L/mol=11.2L,故答案为:2;11.2;
(3)燃料电池的优点是能量转化率高并且排出物不污染环境,故答案为:能量转化率高;排出物不污染环境.
点评 本题考查燃料电池,根据原电池原理及其方程式来分析计算解答即可,注意电极反应式的书写要结合溶液的酸碱性,为易错点.

练习册系列答案
相关题目
14.安全性是汽车发展需要解决的重要问题,安全气囊设计的基本思路是在汽车发生碰撞时,迅速在乘员和汽车内部结构之间打开一个充满气体的袋子,使乘员扑在气袋上,避免或减缓人与汽车的二次碰撞,从而达到保护乘员的目的.气囊中的气体是由化学反应产生的,选择或设计化学反应时需要考虑下列哪些角度( )
①反应速率 ②反应限度 ③气体的量 ④气体毒性 ⑤反应的能量变化.
①反应速率 ②反应限度 ③气体的量 ④气体毒性 ⑤反应的能量变化.
| A. | ①③④ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①③④⑤ |
15.关于裂解和裂化的叙述中,不正确的是( )
| A. | 裂化和裂解产物中都含有不饱和烃 | |
| B. | 裂解和裂化都是为了得到气态烃 | |
| C. | 裂解和裂化的温度不同 | |
| D. | 裂化和裂解都是使相对分子质量大的烃断裂为相对分子质量小的烃的过程 |
13.某元素R的核内含有N个中子,R的质量数为A,在其与氢化合时,R呈-n价,则WgR的气态氢化物中所含电子的物质的量为( )
| A. | $\frac{A}{W+n}$(N-n)mol | B. | $\frac{W}{A+n}$(N+n)mol | C. | $\frac{W}{A+n}$(A-N+n)mol | D. | $\frac{W}{A+n}$(N-A-n)mol |
20.一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( )

| A. | 在20~25min之间,pH=10时R的平均降解速率为0.04 mol•L-1•min-1 | |
| B. | 溶液酸性越强,R的降解速率越小 | |
| C. | R的起始浓度越小,降解速率越大 | |
| D. | 50min时,pH=2和pH=7时R的降解百分率相等 |
10.草酸铁晶体Fe2(C2O4)3•xH2O通过相关处理后可溶于水,且能做净水剂,在110℃可完全失去结晶水.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
步骤1:称量5.20g草酸铁晶体进行处理后,配制成250mL一定物质的量浓度的溶液.
步骤2:取所配溶液25.00mL于锥形瓶中,先加足量稀H2SO4酸化,再滴加KMnO4溶液至草酸恰好全部氧化成二氧化碳,同时MnO4-被还原成Mn2+.向反应后的溶液中加入锌粉,加热至溶液黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤3:用0.0200mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1 mL,滴定中MnO4-被还原成Mn2+.
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200mol/LKMnO4溶液为V2、V3mL.
记录数据如下表:
请回答下列问题:
(1)草酸铁溶液能做净水剂的原因Fe3++3H2O?Fe(OH)3(胶体)+3H+(用离子方程式表示).
(2)该实验步骤1和步骤3中使用的仪器除托盘天平、铁架台、滴定管夹、烧杯、玻璃棒外,需用下列仪器中的A、C、D、F(填序号).
A.酸式滴定管 B.碱式滴定管 C.锥形瓶 D.胶头滴管 E.漏斗 F.250mL容量瓶
(3)实验步骤2中 KMnO4氧化草酸的化学方程式为2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O;加入锌粉的目的是将Fe3+还原为Fe2+.
(4)步骤3滴定时是否选择指示剂否(是或否);滴定终点的判断方法是加入最后一滴KMnO4溶液时,溶液变为浅紫红色,且30s内浅紫红色不褪去.
(5)在步骤3中,下列滴定操作使测得的铁含量偏高的有AB.
A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
C.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数
(6)实验测得该晶体中结晶水的个数x为8.
步骤1:称量5.20g草酸铁晶体进行处理后,配制成250mL一定物质的量浓度的溶液.
步骤2:取所配溶液25.00mL于锥形瓶中,先加足量稀H2SO4酸化,再滴加KMnO4溶液至草酸恰好全部氧化成二氧化碳,同时MnO4-被还原成Mn2+.向反应后的溶液中加入锌粉,加热至溶液黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤3:用0.0200mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1 mL,滴定中MnO4-被还原成Mn2+.
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200mol/LKMnO4溶液为V2、V3mL.
记录数据如下表:
| 实验编号 | KMnO4溶液的浓(mol/L) | KMnO4溶液滴入的体积(mL) |
| 1 | 0.0200 | V1=20.02 |
| 2 | 0.0200 | V2=23.32 |
| 3 | 0.0200 | V3=19.98 |
(1)草酸铁溶液能做净水剂的原因Fe3++3H2O?Fe(OH)3(胶体)+3H+(用离子方程式表示).
(2)该实验步骤1和步骤3中使用的仪器除托盘天平、铁架台、滴定管夹、烧杯、玻璃棒外,需用下列仪器中的A、C、D、F(填序号).
A.酸式滴定管 B.碱式滴定管 C.锥形瓶 D.胶头滴管 E.漏斗 F.250mL容量瓶
(3)实验步骤2中 KMnO4氧化草酸的化学方程式为2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O;加入锌粉的目的是将Fe3+还原为Fe2+.
(4)步骤3滴定时是否选择指示剂否(是或否);滴定终点的判断方法是加入最后一滴KMnO4溶液时,溶液变为浅紫红色,且30s内浅紫红色不褪去.
(5)在步骤3中,下列滴定操作使测得的铁含量偏高的有AB.
A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
C.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数
(6)实验测得该晶体中结晶水的个数x为8.
17.下列各组物质在一定条件下反应,可以制得较纯净的氯乙烷的是( )
| A. | 乙烷与氯气取代 | B. | 乙烯与氢气加成,再用氯气取代 | ||
| C. | 乙烯与氯化氢加成 | D. | 乙烯与氯气加成 |
14.硅是目前半导体工业中最重要的基础原料,其导电性对哦杂质等十分敏感,因此,必须制备高纯度硅.虽然地壳中硅的含量丰富,但大多数以化合物形式存在,需要通过化学方法来制备高纯度的单晶硅,一种简单工艺流程如下:

(1)石英砂的主要成分是SiO2 (填写化学式),反应器甲中发生反应的化学方程式为SiO2+C$\frac{\underline{\;1600-1800℃\;}}{\;}$Si(粗)+2CO↑.
(2)石英砂与焦炭在一定条件下反应也会生成碳化硅,碳化硅又称金刚砂,其晶体类型为原子晶体.
(3)①反应器乙中发生的反应为:Si(s)+3HCl(g)=SiHCl3(g)+H2(g)△H=-210kJ/mol,工业上为了加快SiHC13的生成速率而又不降低硅的转化率,可以采用的方法是催化剂、增大压强或HCl浓度.
②反应器乙所得的反应产物中,SiHCl3大约占85%,还有SiCl4等,有关物质的沸点数据如一下:
提纯SiHCl3的主要工艺操作依次为沉降、冷凝、精馏,其中精馏温度最好控制在31.8℃.
③SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,其水解的反应方程式为SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑.
(4)反应器丙中发生的反应的化学方程式为H2+SiHCl3$\frac{\underline{\;1100-1200℃\;}}{\;}$Si+3HCl
(5)该生产工艺中可以循环使用的物质是氯化氢、氢气.

(1)石英砂的主要成分是SiO2 (填写化学式),反应器甲中发生反应的化学方程式为SiO2+C$\frac{\underline{\;1600-1800℃\;}}{\;}$Si(粗)+2CO↑.
(2)石英砂与焦炭在一定条件下反应也会生成碳化硅,碳化硅又称金刚砂,其晶体类型为原子晶体.
(3)①反应器乙中发生的反应为:Si(s)+3HCl(g)=SiHCl3(g)+H2(g)△H=-210kJ/mol,工业上为了加快SiHC13的生成速率而又不降低硅的转化率,可以采用的方法是催化剂、增大压强或HCl浓度.
②反应器乙所得的反应产物中,SiHCl3大约占85%,还有SiCl4等,有关物质的沸点数据如一下:
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 |
③SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,其水解的反应方程式为SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑.
(4)反应器丙中发生的反应的化学方程式为H2+SiHCl3$\frac{\underline{\;1100-1200℃\;}}{\;}$Si+3HCl
(5)该生产工艺中可以循环使用的物质是氯化氢、氢气.
13.下列叙述错误的是( )
| A. | 共价化合物中只含共价键 | |
| B. | 碳酸氢铵受热分解产生氨气不仅破坏离子键还破坏了共价键 | |
| C. | 干冰变为二氧化碳气体,因共价键被破坏需吸收能量 | |
| D. | 离子化合物中可能含有共价键 |