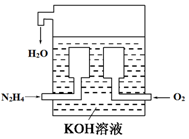
题目内容
10.草酸铁晶体Fe2(C2O4)3•xH2O通过相关处理后可溶于水,且能做净水剂,在110℃可完全失去结晶水.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:步骤1:称量5.20g草酸铁晶体进行处理后,配制成250mL一定物质的量浓度的溶液.
步骤2:取所配溶液25.00mL于锥形瓶中,先加足量稀H2SO4酸化,再滴加KMnO4溶液至草酸恰好全部氧化成二氧化碳,同时MnO4-被还原成Mn2+.向反应后的溶液中加入锌粉,加热至溶液黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤3:用0.0200mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1 mL,滴定中MnO4-被还原成Mn2+.
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200mol/LKMnO4溶液为V2、V3mL.
记录数据如下表:
| 实验编号 | KMnO4溶液的浓(mol/L) | KMnO4溶液滴入的体积(mL) |
| 1 | 0.0200 | V1=20.02 |
| 2 | 0.0200 | V2=23.32 |
| 3 | 0.0200 | V3=19.98 |
(1)草酸铁溶液能做净水剂的原因Fe3++3H2O?Fe(OH)3(胶体)+3H+(用离子方程式表示).
(2)该实验步骤1和步骤3中使用的仪器除托盘天平、铁架台、滴定管夹、烧杯、玻璃棒外,需用下列仪器中的A、C、D、F(填序号).
A.酸式滴定管 B.碱式滴定管 C.锥形瓶 D.胶头滴管 E.漏斗 F.250mL容量瓶
(3)实验步骤2中 KMnO4氧化草酸的化学方程式为2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O;加入锌粉的目的是将Fe3+还原为Fe2+.
(4)步骤3滴定时是否选择指示剂否(是或否);滴定终点的判断方法是加入最后一滴KMnO4溶液时,溶液变为浅紫红色,且30s内浅紫红色不褪去.
(5)在步骤3中,下列滴定操作使测得的铁含量偏高的有AB.
A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
C.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数
(6)实验测得该晶体中结晶水的个数x为8.
分析 (1)草酸铁溶液中铁离子水解生成氢氧化铁胶体,胶体具有吸附悬浮杂质的作用;
(2)步骤1:称量5.20g草酸铁晶体进行处理后,配制成250mL一定物质的量浓度的溶液,结合配制溶液的步骤为:称量、溶解、转移、定容、摇匀等步骤选择需要的仪器,步骤3:用0.0200mol/LKMnO4溶液滴定步骤2所得溶液至终点,需要锥形瓶、滴定管等;
(3)KMnO4氧化草酸生成二氧化碳,高锰酸钾被还原为硫酸锰,结合原子守恒和电子守恒配平书写化学方程式,加入锌粉的目的是还原铁离子;
(4)高锰酸钾溶液为紫红色,滴入最后一滴溶液变为紫红色且半分钟不变说明反应达到终点;
(5)依据滴定误差分析的方法判断,误差可以归结为标准液的体积消耗变化分析误差,c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$;
A.酸式滴定管要用标准液润洗;
B.滴定前滴定管尖嘴处有气泡,滴定后气泡消失,读取标准溶液体积增大;
C.读取标准液体积时,滴定前平视读数,滴定后俯视读数,读取标准溶液体积减小;
(6)根据离子方程式计算,n(Fe)=5n(MnO4-),可以计算n(Fe),然后可以计算晶体中Fe2(C2O4)3物质的量,根计算摩尔质量得到x的值.
解答 解:(1)草酸铁溶液中铁离子水解生成氢氧化铁胶体,胶体具有吸附悬浮杂质的作用,反应的离子方程式为:Fe3++3H2O?Fe(OH)3(胶体)+3H+,
故答案为:Fe3++3H2O?Fe(OH)3(胶体)+3H+;
(2)步骤1:称量5.20g草酸铁晶体进行处理后,配制成250mL一定物质的量浓度的溶液,结合配制溶液的步骤为:称量、溶解、转移、定容、摇匀等步骤选择需要的仪器主要有:托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管等,步骤3:用0.0200mol/LKMnO4溶液滴定步骤2所得溶液至终点,高锰酸钾溶液具有强氧化性,能腐蚀橡胶管,需要盛放在酸式滴定管则,滴定过程中需要锥形瓶、铁架台等,该实验步骤1和步骤3中使用的仪器除托盘天平、铁架台、滴定管夹、烧杯、玻璃棒外,需用下列仪器中的A、C、D、F,
故答案为:A、C、D、F;
(3)KMnO4氧化草酸生成二氧化碳,高锰酸钾被还原为硫酸锰,结合原子守恒和电子守恒配平书写化学方程式,加入锌粉的目的是将Fe3+还原为Fe2+,
故答案为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O;将Fe3+还原为Fe2+;
(4)高锰酸钾溶液为紫红色,步骤3滴定时不需要选择指示剂,反应终点判断为:加入最后一滴KMnO4溶液时,溶液变为浅紫红色,且30s内浅紫红色不褪去,
故答案为:否;加入最后一滴KMnO4溶液时,溶液变为浅紫红色,且30s内浅紫红色不褪去;
(5)A.酸式滴定管要用标准液润洗,滴定管用蒸馏水洗涤后,立即装入标准液,标准液浓度减小,消耗标准液体积增大,测定结果偏高,故A符合;
B.滴定前滴定管尖嘴处有气泡,滴定后气泡消失,读取标准溶液体积增大,测定结果偏高,故B符合;
C.读取标准液体积时,滴定前平视读数,滴定后俯视读数,读取标准溶液体积减小,测定结果偏小,故C不符合;
故答案为:AB;
(6)用0.0200mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1 mL,滴定中MnO4-被还原成Mn2+.
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200mol/LKMnO4溶液为V2、V3mL,计算平均值,实验2数值误差较大舍去,消耗体积V=$\frac{20.02+19.98}{2}$ml=20.00ml,
铁元素守恒,高锰酸钾溶液滴定亚铁离子发生的反应为:
5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
5 1
n 0.0200mol/L×0.0200L
n=0.002mol,
250ml溶液中含铁元素物质的量=0.002mol×$\frac{250}{25}$=0.02mol,Fe2(C2O4)3•xH2O物质的量=0.01mol,
5.20g草酸铁晶体摩尔质量=$\frac{5.20g}{0.01mol}$=520g/mol,
Fe2(C2O4)3•xH2O=520,
x=8,
故答案为:8.
点评 本题考查了物质性质的实验探究,实验方案的设计与分析计算,主要是滴定实验的过程分析和误差分析,掌握基础是关键,题目难度中等.

| A. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内质子数多于中子数 |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 该反应的化学方程式是:H2(g)+CO2(g)?CO(g)+H2O(g) | |
| B. | 上述反应的正反应是吸热反应 | |
| C. | 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830℃,如果此时测得CO2为0.5 mol,则该反应达到平衡状态 | |
| D. | 某温度下,如果平衡常数符合下列关系式:$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,则此时温度700℃ |
| A. | 丙烯的分子式为:CH3CH=CH2 | B. | H2O2的电子式为: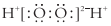 | ||
| C. | S2-的离子结构示意图为: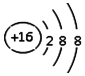 | D. | 苯的比例模型为: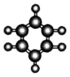 |
| A. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 | |
| B. | 镉元素属于重金属元素,食用‘镉大米’会影响骨骼和肾脏 | |
| C. | 使用增塑剂--邻苯二甲酸酯可使聚氯乙烯由弹性塑胶变为硬塑胶 | |
| D. | 面粉生产中禁止添加的过氧化钙(CaO2)中阴、阳离子的个数之比为2:1 |
| A. | N2完全转化为NH3时,即可视为达到化学平衡状态 | |
| B. | 达到化学平衡时,容器内压强和气体密度都不再变化 | |
| C. | 达到化学平衡时,反应则停止进行 | |
| D. | 达到化学平衡时,3ν(逆NH3)=2ν(正H2) |
 ;
; 短周期元素X、Y的价电子数相同,且原子序数比等于$\frac{1}{2}$;元素Z位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
短周期元素X、Y的价电子数相同,且原子序数比等于$\frac{1}{2}$;元素Z位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.