题目内容
 (1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g).若已知:
(1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g).若已知:N2(g)+3H2(g)=2NH3(g)△H=a kJ/mol;
2H2(g)+O2(g)=2H2O(l)△H=b kJ/mol
则:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H=
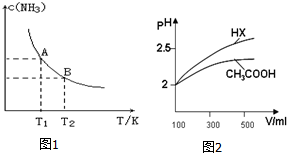
(2)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图1所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.
①该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为
②当温度由T1变化到T2时,平衡常 数关系K1
③T1温度下该反应的化学平衡常数K1=
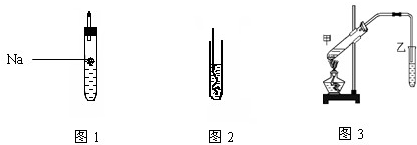
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图2所示,则Ka(HX)
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中C(CH3COO-)-c(Na+)=
(5)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀的离子方程式为
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20)
考点:用盖斯定律进行有关反应热的计算,化学平衡的计算,难溶电解质的溶解平衡及沉淀转化的本质,酸碱混合时的定性判断及有关ph的计算
专题:
分析:(1)根据盖斯定律求△H;
(2)①令参加反应的氮气的物质的量为nmol,利用三段式用n表示处于平衡时各组分的物质的量,根据氨气的体积分数列方程计算n的值,再计算用N2表示的化学反应速率;
②由图1可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,平衡常数减小;
③根据平衡常数表达式带入平衡浓度计算T1温度下该反应的化学平衡常数K1;
(3)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;
(4)25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-);
(5)根据溶度积常数确定先沉淀的物质,溶度积常数越小的物质越先沉淀,铜离子和氨水反应生成氢氧化铜和铵根离子.
(2)①令参加反应的氮气的物质的量为nmol,利用三段式用n表示处于平衡时各组分的物质的量,根据氨气的体积分数列方程计算n的值,再计算用N2表示的化学反应速率;
②由图1可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,平衡常数减小;
③根据平衡常数表达式带入平衡浓度计算T1温度下该反应的化学平衡常数K1;
(3)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;
(4)25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-);
(5)根据溶度积常数确定先沉淀的物质,溶度积常数越小的物质越先沉淀,铜离子和氨水反应生成氢氧化铜和铵根离子.
解答:
解:(1)因为①N2(g)+3H2(g)=2NH3(g)△H=a kJ/mol;②2H2(g)+O2(g)=2H2O(l)△H=b kJ/mol,根据盖斯定律可知,目标反应为2×①-3×②,所以2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=(2a-3b)kJ/mol,故答案为:(2a-3b)kJ/mol;
(2)①令参加反应的氮气的物质的量为nmol,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):1 3 0
变化(mol):n 3n 2n
平衡(mol):1-n 3-3n 2n
所以所以
×100%=25%,解得n=0.4,这段时间内N2的化学反应速率为为:
=8.00×10-3mol/(L?min),
故答案为:8.00×10-3mol/(L?min);
②由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,平衡常数减小,故平衡常数KA>KB,温度越高,K值越小,所以正反应是放热反应,故答案为:>;<;
③N2(g)+3H2(g)?2NH3(g)
开始(mol):1 3 0
变化(mol):0.4 1.2 0.8
平衡(mol):0.6 1.8 0.8
平衡浓度(mol/L) 0.06 0.18 0.08
K1=
=
=18.3
故答案为:18.3;
(3)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,HX的电离平衡常数更大,Ka(HX)大于Ka(CH3COOH),故答案为:>;
(4)25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=9.9×10-7mol/L,
故答案为:9.9×10-7;
(5)溶度积常数越小的物质越先沉淀,氢氧化铜的溶度积小于氢氧化镁的溶度积,所以氢氧化铜先沉淀,铜离子和氨水反应生成氢氧化铜沉淀和铵根离子,离子方程式为Cu2++2NH3?H2O?Cu(OH)2↓+2NH4+.
故答案为:Cu2++2NH3?H2O?Cu(OH)2↓+2NH4+.
(2)①令参加反应的氮气的物质的量为nmol,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):1 3 0
变化(mol):n 3n 2n
平衡(mol):1-n 3-3n 2n
所以所以
| 2n |
| (1-n)mol+(3-3n)mol+2nmol |
| ||
| 5.00min |
故答案为:8.00×10-3mol/(L?min);
②由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,平衡常数减小,故平衡常数KA>KB,温度越高,K值越小,所以正反应是放热反应,故答案为:>;<;
③N2(g)+3H2(g)?2NH3(g)
开始(mol):1 3 0
变化(mol):0.4 1.2 0.8
平衡(mol):0.6 1.8 0.8
平衡浓度(mol/L) 0.06 0.18 0.08
K1=
| c2(NH3) |
| c(N2)?c3(H2) |
| 0.082 |
| 0.06×0.183 |
故答案为:18.3;
(3)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,HX的电离平衡常数更大,Ka(HX)大于Ka(CH3COOH),故答案为:>;
(4)25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=9.9×10-7mol/L,
故答案为:9.9×10-7;
(5)溶度积常数越小的物质越先沉淀,氢氧化铜的溶度积小于氢氧化镁的溶度积,所以氢氧化铜先沉淀,铜离子和氨水反应生成氢氧化铜沉淀和铵根离子,离子方程式为Cu2++2NH3?H2O?Cu(OH)2↓+2NH4+.
故答案为:Cu2++2NH3?H2O?Cu(OH)2↓+2NH4+.
点评:本题考查了反应热的计算、平衡计算、电解质溶液中的离子平衡,中等难度,注意基础知识的掌握和运用.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目

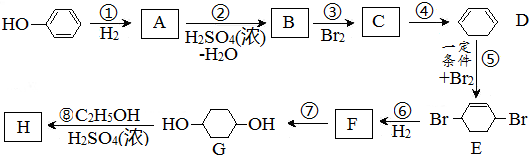
 合成
合成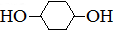 .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)