题目内容
已知下列反应:Co2O3+6HCl(浓)═2CoCl2+Cl2↑+3H2O(Ⅰ);5Cl2+I2+6H2O═10HCl+2HIO3(Ⅱ).
下列说法正确的是( )
下列说法正确的是( )
| A、还原性:CoCl2>HCl>I2 |
| B、氧化性:Co2O3>Cl2>HIO3 |
| C、反应Ⅰ中HCl是氧化剂 |
| D、反应Ⅱ中Cl2发生氧化反应 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:Co2O3+6HCl(浓)═2CoCl2+Cl2↑+3H2O中Co元素的化合价降低,Cl元素的化合价升高,
5Cl2+I2+6H2O═10HCl+2HIO3中Cl元素的化合价降低,I元素的化合价升高,结合氧化还原反应基本概念来解答.
5Cl2+I2+6H2O═10HCl+2HIO3中Cl元素的化合价降低,I元素的化合价升高,结合氧化还原反应基本概念来解答.
解答:
解:A.由还原剂的还原性大于还原产物的还原性可知,I中还原性为HCl>CoCl2,II中还原性为I2>HCl,故A错误;
B.由氧化剂的氧化性大于氧化产物的氧化性可知,I中氧化性为Co2O3>Cl2,II中氧化性为Cl2>HIO3,则氧化性为Co2O3>Cl2>HIO3,故B正确;
C.反应I中Cl元素的化合价升高,则HCl为还原剂,故C错误;
D.II中Cl元素的化合价降低,则氯气发生还原反应,故D错误;
故选B.
B.由氧化剂的氧化性大于氧化产物的氧化性可知,I中氧化性为Co2O3>Cl2,II中氧化性为Cl2>HIO3,则氧化性为Co2O3>Cl2>HIO3,故B正确;
C.反应I中Cl元素的化合价升高,则HCl为还原剂,故C错误;
D.II中Cl元素的化合价降低,则氯气发生还原反应,故D错误;
故选B.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意氧化性、还原性比较的规律性方法,题目难度不大.

练习册系列答案
相关题目
长期食用下列食物,可能引起人体酸中毒的是( )
| A、鱿鱼干 | B、菠菜 | C、苹果 | D、西瓜 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
| A、NaOH固体 |
| B、NH4Cl固体 |
| C、CH3COONa固体 |
| D、NaNO3固体 |
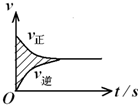 在容积固定的2L 密闭容器中进行着一个可逆反应X(g)+2Y(g)?2Z(g),用Y的物质的量浓度改变表示的反应速率v正、v逆与时间的关系如图所示.已知v的单位为mol?(L?s)-1,则图中阴影部分的面积表示( )
在容积固定的2L 密闭容器中进行着一个可逆反应X(g)+2Y(g)?2Z(g),用Y的物质的量浓度改变表示的反应速率v正、v逆与时间的关系如图所示.已知v的单位为mol?(L?s)-1,则图中阴影部分的面积表示( )| A、X的物质的量浓度的减少 |
| B、Y的物质的量浓度的减少 |
| C、Z的物质的量的增加 |
| D、Y的物质的量的减少 |
下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是( )
| A、Na2SO4 |
| B、CH3COONa |
| C、NH4Cl |
| D、HClO |
下列化学方程式不能用Ba2++SO42-═BaSO4↓来表示的是( )
| A、Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 |
| B、BaCO3+H2SO4═BaSO4↓+CO2↑+H2O |
| C、Na2SO4+BaCl2═BaSO4↓+2NaCl |
| D、BaCl2+H2SO4═BaSO4↓+2HCl |
下列反应既属于化合反应,又属于氧化还原反应的是( )
| A、Fe+2HCl═H2+FeCl2 |
| B、2FeCl2+Cl2═2FeCl3 |
| C、CaO+H2O═Ca(OH)2 |
| D、2Fe(OH)3═Fe2O3+3H2O |
阿伏加德罗常数为NAmol-1,下列叙述正确的是( )
| A、1molSO2的质量为64g/mol |
| B、CH4的摩尔质量为16g |
| C、SO2的摩尔质量等于SO2的相对分子质量 |
| D、NA个SO2的质量以克为单位与SO2的相对分子质量在数值上相等 |