题目内容
20.下列过程中不放出热量的是( )| A. | 碳酸钠固体中加少量水 | B. | 碳酸氢钠固体中加少量水 | ||
| C. | 钠与水的反应 | D. | 过氧化钠与水反应 |
分析 A.碳酸钠固体溶解时放热;
B.碳酸氢钠固体溶解时吸热;
C.金属与水反应属于放热反应;
D.过氧化钠与水反应属于放热反应.
解答 解:A.碳酸钠固体易溶于水,溶解时放热,故A错误;
B.碳酸氢钠固体溶解时吸热热量,故B正确;
C.钠与水的反应时放出大量的热,属于放热反应,故C错误;
D.过氧化钠与水反应属于放热反应,故D错误;
故选B.
点评 本题考查了溶解热和反应热,难度不大,掌握常见的吸热反应、放热反应和常见物质的溶解热是解题关键.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
10.钢铁厂在冷轧过程中会产生高浓度酸性含铁废水,主要含有H+、Cl-、Fe2+、Fe3+等,其处理的主要工艺流程如下:
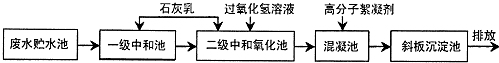
请回答:
(1)废水未经处理直接排放的危害是ab(填字母).
a腐蚀水利设施 b影响水生生物的自然生长
(2)石灰乳用于中和含铁废水中的酸,写出石灰乳与盐酸反应的化学方程式:Ca(OH)2+2HCl═CaCl2+2H2O.
(3)过氧化氧的主要作用是b(填字母).a还原剂 b氧化剂
(4)自来水厂常用漂白粉、液氯、二氧化氯、臭氧等作为消毒剂,杀灭水中的细菌.液氯注入水中后,能杀死水中细菌的物质是HClO(填化学式).
(5)污水处理中的主要化学方法有中和法、混凝法_、_沉淀法_、氧化还原法.
(6)某研究小组对钢铁厂高浓度酸性含铁废水进行监测时,取其样本稀释,测得有关数据如下:
稀释后的溶液中c(Fe2+)=0.12mol/L.

请回答:
(1)废水未经处理直接排放的危害是ab(填字母).
a腐蚀水利设施 b影响水生生物的自然生长
(2)石灰乳用于中和含铁废水中的酸,写出石灰乳与盐酸反应的化学方程式:Ca(OH)2+2HCl═CaCl2+2H2O.
(3)过氧化氧的主要作用是b(填字母).a还原剂 b氧化剂
(4)自来水厂常用漂白粉、液氯、二氧化氯、臭氧等作为消毒剂,杀灭水中的细菌.液氯注入水中后,能杀死水中细菌的物质是HClO(填化学式).
(5)污水处理中的主要化学方法有中和法、混凝法_、_沉淀法_、氧化还原法.
(6)某研究小组对钢铁厂高浓度酸性含铁废水进行监测时,取其样本稀释,测得有关数据如下:
| 离子 | H+ | Cl- | Fe2+ | Fe3+ |
| 浓度(mol•L)-1 | 0.16 | 0.94 | 0.18 |
8.某溶液中可能含有H+、NH4+、Fe3+、CO32-、SO42-、NO3-中的几种,且各种离子浓度相等.加入铝片,产生H2.现往原溶液中逐滴加入Ba(OH)2溶液至过量,可能发生的离子反应是( )
| A. | H++NH4++2OH-→NH3+2H2O | |
| B. | Ba2++2OH-+SO42-+2H+→BaSO4↓+2H2O | |
| C. | 2Ba2++6OH-+2SO42-+2Fe3+→2BaSO4↓+2Fe(OH)3↓ | |
| D. | Ba2++2OH-+SO42-+NH4++H+→NH3+BaSO4↓+2H2O |
15. 钠及其化合物在生产和生活中有广泛的应用.完成下列计算:
钠及其化合物在生产和生活中有广泛的应用.完成下列计算:
(1)钠铝合金可作核反应堆的载热介质.取1.46g的钠铝合金放入水中,合金全部溶解,放出1.12L氢气(标准状况),则该钠铝合金的化学式为Na2Al.
(2)NaCN是一种剧毒的化工原料,可用双氧水处理含NaCN的废液,发生反应的方程式为:NaCN+H2O2+H2O=NaHCO3+NH3.若处理含NaCN 4.90g的废液,需用15%的H2O221.65mL.(已知15% H2O2的密度是1.047g/mL)(保留2位小数)
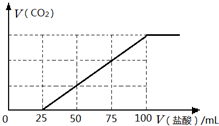
(3)向100mL NaOH溶液中通入一定量的CO2气体,充分反应后得到溶液A,再向A中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.试计算溶液A的溶质成份及其物质的量.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠.通过计算,分析和比较上表3组数据,给出结论.
 钠及其化合物在生产和生活中有广泛的应用.完成下列计算:
钠及其化合物在生产和生活中有广泛的应用.完成下列计算:(1)钠铝合金可作核反应堆的载热介质.取1.46g的钠铝合金放入水中,合金全部溶解,放出1.12L氢气(标准状况),则该钠铝合金的化学式为Na2Al.
(2)NaCN是一种剧毒的化工原料,可用双氧水处理含NaCN的废液,发生反应的方程式为:NaCN+H2O2+H2O=NaHCO3+NH3.若处理含NaCN 4.90g的废液,需用15%的H2O221.65mL.(已知15% H2O2的密度是1.047g/mL)(保留2位小数)
(3)向100mL NaOH溶液中通入一定量的CO2气体,充分反应后得到溶液A,再向A中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.试计算溶液A的溶质成份及其物质的量.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
5.下列关于电解质的说法错误的是( )
| A. | 电解质本身在常温常压下不一定导电 | |
| B. | 盐酸导电所以它是电解质 | |
| C. | 酸、碱、盐是电解质 | |
| D. | 氯化钠加入水中,在水分子作用下,形成自由移动的水合离子 |
12.如图表示酸雨的形成,关于酸雨下列说法正确的是( )


| A. | 酸雨的PH为5.6 | |
| B. | 酸雨的形成过程发生了氧化还原反应 | |
| C. | 酸雨的主要成分为氮、硫元素的氧化物 | |
| D. | 形成酸雨的主要原因是因为雷雨天气 |
9.只改变一个影响因素,平衡常数K与平衡移动的关系叙述不正确的是( )
| A. | K值不变,平衡可能移动 | |
| B. | 平衡向右移动时,K值不一定移动 | |
| C. | K值有变化,平衡一定移动 | |
| D. | 相同条件下,同一个反应的方程式的化学计量数增大2倍,K值也增大两倍 |
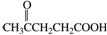 合成聚芳酯E的路线:
合成聚芳酯E的路线: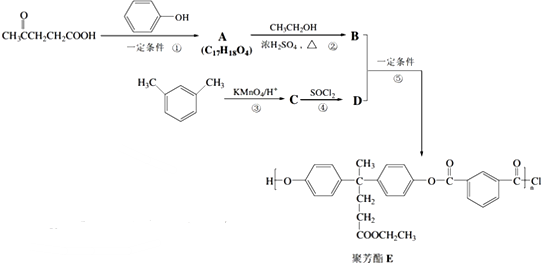
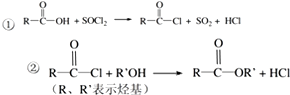
 .
. .
.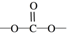 结构
结构 .
.